Cardiología
raquelserrano
Jue, 09/05/2024 - 10:00
Nuevas guías clínicas en 'JACC' y 'Circulation'

Especialistas del Colegio Estadounidense de Cardiología (ACC) y la Asociación Estadounidense del Corazón (AHA) publican hoy una nueva guía clínica para el tratamiento eficaz de personas diagnosticadas con miocardiopatía hipertrófica (MH), según publican simultáneamente The Journal of the American College of Cardiology (JACC) y Circulation.
La guía -en cuya elaboración también han participado las sociedades Médica Estadounidense de Medicina Deportiva, la de Ritmo Cardíaco, de Electrofisiología Congénita y Pediátrica y la de Cardiología de Resonancia Magnética-, reitera la importancia de la toma de decisiones colaborativa con los pacientes con MH y proporciona recomendaciones actualizadas sobre las vías de tratamiento más efectivas para pacientes adultos y pediátricos.
La MH es una afección cardíaca hereditaria que afecta aproximadamente a 1 de cada 500 personas. Sin embargo, una parte importante de los casos permanece sin diagnosticar porque muchas personas no presentan síntomas. En ocasiones, la primera vez que se diagnostica MH es después de una muerte súbita. Si aparecen síntomas se experimenta episodios de desmayos, dolor en el pecho, dificultad para respirar o latidos cardíacos irregulares.
Según Steve R. Ommen, director médico de Miocardiopatía Hipertrófica de la Clínica Mayo, Estados Unidos, y presidente del comité de redacción de la guía, "al incorporar los datos más recientes, esta nueva guía brinda a los médicos las últimas recomendaciones para el tratamiento de la MH. "Estamos acumulando más evidencia de que los pacientes con MH pueden regresar a su vida diaria normal con la atención y el manejo adecuados".
Además del tratamiento farmacológico, cada vez hay más pruebas que demuestran que los beneficios del ejercicio superan los riesgos potenciales para los pacientes con MH. El ejercicio recreativo de intensidad baja a moderada debería ser parte de la forma en que los pacientes con MH manejan su salud general. Para algunos pacientes con MH, los deportes competitivos deben establecerse en consulta con las oportunas recomendaciones de especialistas en esta patología.
Intensidad baja a moderada o...vigorosa
A su juicio, las recomendaciones para la actividad física continúan evolucionando con la investigación. "Como parte de un estilo de vida saludable, ahora se anima a los pacientes con MH a realizar actividades físicas de intensidad baja a moderada. Así mismos estamos viendo cómo las actividades físicas vigorosas pueden ser razonables para algunas personas. Con la toma de decisiones compartida entre el médico y el paciente, algunos pacientes pueden incluso volver a practicar deportes competitivos".
El ejercicio físico se convierte así, en un nuevo medicamento que los profesionales empiezan a prescribir como parte del tratamiento integral de una patología. Como ya adelantó DM, la actividad -que debe realizarse de forma individual, en función de cada paciente-, puede resultar de gran utilidad en numerosas patologías. Ya se evidenciaron beneficios en el caso de pacientes afectados por la covid-19 y se ha analizado su efectividad en la recuperación para muchos tipos de cáncer, como el caso del mama.
En los últimos años, de hecho, se ha ido incorporando como un 'coadyuvante universal' que cada vez 'se receta' más, ya que influye en el pronóstico y evolución de múltiples patologías. La actividad física puede considerarse como una herramienta integral en el tratamiento de diversas patologías, "actuando como coadyuvante terapéutico en enfermedades crónicas, trastornos musculoesqueléticos y salud mental. A lo largo de las últimas dos décadas, se ha acumulado evidencia sustancial destacando la importancia del ejercicio como tratamiento primario para varias de estas enfermedades crónicas", señalaba a DM Antonio García Hermoso, investigador responsable de la Unidad de Actividad Física Infanto-Juvenil del Centro de Investigación Biomédica Navarrabiomed.
En la misma línea, Enrique Sainz de Murieta, secretario del Grupo de Trabajo de Obesidad de la Sociedad Española de Rehabilitación y Medicina Física (Sermef), indicaba que si el ejercicio se pudiese recetar como una pastilla, "sería la más prescrita", añadiendo que "son pocos los pacientes que no se pueden beneficiar de sus efectos", con la ventaja de que "sería una de las medicinas más efectivas, seguras y baratas”.
Inactividad asociada a 35 patologías
Un estudio de los investigadores Pedersen y Saltin, de la Universidad de Copenhague, proporciona pruebas del ejercicio como medicina en 26 enfermedades diferentes. Por el contrario, la inactividad física está asociada, al menos, a 35 patologías crónicas no transmisibles. En términos generales, la actividad física puede contribuir a la prevención y reducción del uso de medicamentos en algunos casos, como dislipemia, hipertensión y diabetes, mejorando así la calidad de vida.
El ejercicio aeróbico, por ejemplo, podría ser también un buen aliado frente a la esteatohepatitis no alcoholica (Nafld), según datos publicados en Metabolism, en cáncer de mama, patología en la que en la que ha encontrado un beneficio en supervivencia al combinar ejercicio aeróbico y de fuerza, sin olvidar otros tipos tumorales como colon y próstata. También se ha demostrado una disminución de mortalidad por cualquier causa (principalmente de origen cardiovascular) en el cáncer de endometrio, en el de ovario y en el de pulmón.
Marta Supervía Pola, portavoz de la Sociedad Española de Rehabilitación y Medicina Física (Sermef), recalcaba además la importancia de realizar ejercicio físico como defensa natural del sistema inmune, ya que “mejora la respuesta inmunitaria y, por tanto, ayuda a reducir el riesgo de enfermar”. Sería un perfecto aliado frente a virus, fundamentalmente, respiratorios.
No obstante, García Hermoso subraya que hay que dejar claro "no siempre sustituye al tratamiento farmacológico y su eficacia está condicionada a la naturaleza específica de la enfermedad, así como a la supervisión de profesionales".
Nuevas recomendaciones farmacológicas en MH
Las recomendaciones actualizadas de la guía que han elaborado los cardiólogos estadounidenses reflejan, por tanto, evidencia reciente sobre el tratamiento y manejo de la MH, incluidas nuevas formas de manejo farmacológico; participación en vigorosas actividades recreativas y deportes competitivos; y estratificación del riesgo de muerte súbita cardíaca, con énfasis en pacientes pediátricos.
La guía incluye recomendaciones para agregar inhibidores de la miosina cardíaca, una nueva clase de medicamento para pacientes con MH obstructiva sintomática que no obtienen un alivio adecuado de los síntomas con la terapia farmacológica de primera línea.
La MCH obstructiva sintomática es un tipo de MH en la que el músculo cardíaco está restringido. Los inhibidores de la miosina cardíaca son la primera clase de medicamento aprobado por la FDA estadounidense que se dirige específicamente al engrosamiento del músculo cardíaco en lugar de tratar los síntomas. Sin embargo, se controlan según el programa de Estrategias de Mitigación y Evaluación de Riesgos (REMS) de la FDA, que puede crear pasos adicionales y tiempo tanto para el clínico como para el paciente. Los médicos requieren una formación especial para recetar el medicamento y los pacientes requieren exámenes de detección periódicos.
Según Ommen, presidente del comité de redacción de la guía, "estos nuevos medicamentos ofrecen una alternativa para los pacientes que han fracasado en la terapia de primera línea y quieren retrasar o posiblemente evitar opciones más agresivas". La nueva guía clínica ofrece así a los profesionales orientación en el punto de atención sobre cómo utilizar eficazmente esta opción de tratamiento basada en evidencia, primera en su clase, y mejorar la calidad de vida de sus pacientes, señala el informe.
Ejercicio físico, un coadyuvante universal, Los médicos de Canarias harán "recetas deportivas" para prescribir ejercicio físico, Ejercicio físico: la prescripción que impulsa la supervivencia en cáncer
La MH mal manejada puede provocar múltiples complicaciones, incluida la muerte súbita. La nueva directriz incluye recomendaciones para evaluar y gesti
Cada día 'se receta' más como parte de un tratamiento integral. Ahora, los cardiólogos estadounidenses lo recomiendan en sus nuevas guías clínicas de miocardiopatía hipertrófica.
Off
Raquel Serrano
Medicina Física y Rehabilitación
Oncología
Aparato Digestivo
Psiquiatría
Medicina Interna
Pediatría
Farmacología
Inmunología
Off


















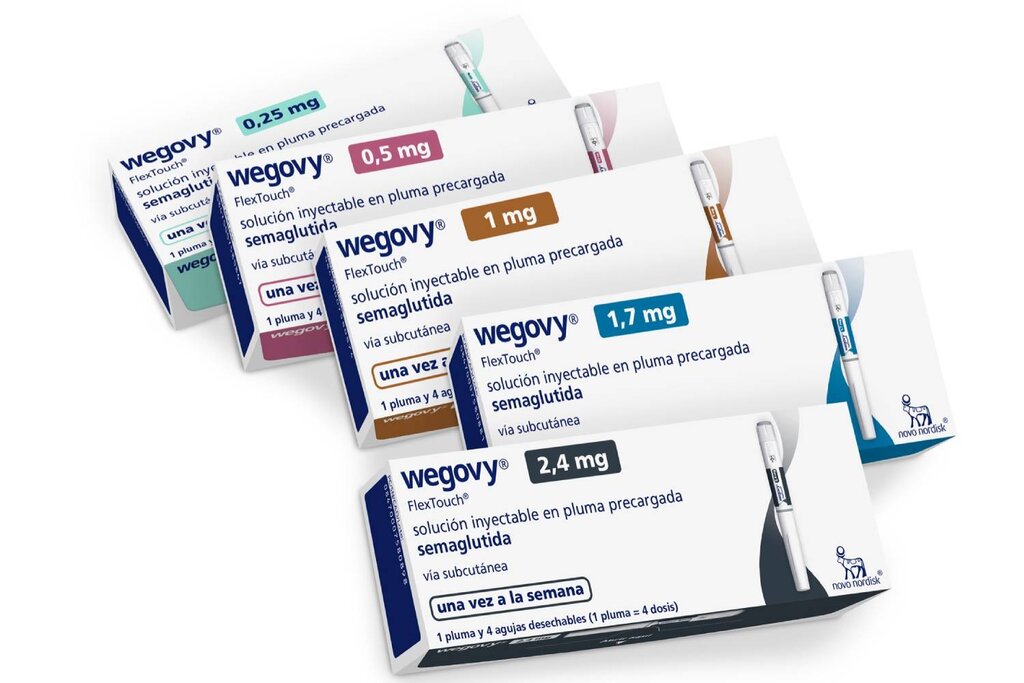 Presentaciones del medicamento para obesidad 'Wegovy'. Foto: NOVO NORDISK
Presentaciones del medicamento para obesidad 'Wegovy'. Foto: NOVO NORDISK
















 Grupo del HM CINAC. Foto: HM CINAC
Grupo del HM CINAC. Foto: HM CINAC



 José Manuel Cameselle, Susana Bravo, Mari Suárez Fariña, Miguel Chenlo, Sihara Pérez Romero, Clara Álvarez y Narciso Blanco, profesionales que han realizado la investigación. Foto: CIMUS.
José Manuel Cameselle, Susana Bravo, Mari Suárez Fariña, Miguel Chenlo, Sihara Pérez Romero, Clara Álvarez y Narciso Blanco, profesionales que han realizado la investigación. Foto: CIMUS.

























 Federico Martinón, jefe de grupo del CiberES en el CHUS, en las jornadas.
Federico Martinón, jefe de grupo del CiberES en el CHUS, en las jornadas.











 Filippo Veglia, del Programa de Inmunología, Microambiente y Metástasis del Instituto Wistar. Foto: WISTAR.
Filippo Veglia, del Programa de Inmunología, Microambiente y Metástasis del Instituto Wistar. Foto: WISTAR.