InmunologÃa
cristinareal
Dom, 01/10/2023 - 08:00
Afecta a 300.000 espaÃąoles

Los pacientes de urticaria crÃģnica tardan una media de tres aÃąos en conseguir un diagnÃģstico. IlustraciÃģn: SHUTTERSTOCK.
Desde que comienzan los primeros sÃntomas, los pacientes de urticaria crÃģnica tardan una media de tres aÃąos en conseguir un diagnÃģstico, pasando del mÃĐdico de familia al especialista o, incluso, por urgencias hasta dar con la razÃģn de sus males. Asà se expuso en un encuentro informativo organizado por Diario MÃĐdico, apoyado en los datos del Atlas de la Urticaria CrÃģnica en EspaÃąa, un informe promovido por Novartis y la AsociaciÃģn de Afectados de Urticaria CrÃģnica (AAUC) y revisado por la Academia EspaÃąola de DermatologÃa y VenereologÃa (AEDV) y la Sociedad EspaÃąola de AlergologÃa e InmunologÃa ClÃnica (Seaic), en el que se han recogido las respuestas de mÃĄs de 600 pacientes, que participaron entre los meses de mayo de 2021 y 2022.
En el evento estuvieron presentes algunos de los autores y profesionales que han formado parte de los comitÃĐs cientÃficos que avalan el documento: Ana GimÃĐnez-Arnau, dermatÃģloga especialista en esta enfermedad en el Hospital del Mar (Barcelona); Marta Ferrer, especialista en AlergologÃa e InmunologÃa ClÃnica y decana de la Facultad de Medicina de la Universidad de Navarra; Ignacio JÃĄuregui, especialista en AlergologÃa del Hospital Universitario de Cruces (Vizcaya); Esther Serra, jefa de la Unidad de Enfermedades InmunoalÃĐrgicas CutÃĄneas del Servicio de DermatologÃa del Hospital de la Santa Creu i Sant Pau (Barcelona), y Adriana GarcÃa, presidenta de la AsociaciÃģn de Afectados de Urticaria CrÃģnica.
Para abrir el encuentro, GarcÃa hizo un breve resumen de los datos recogidos en el estudio. "A pesar de ser una enfermedad que afecta en EspaÃąa a unos 300.000 pacientes, suele pasar inadvertida", comentÃģ. Otro aspecto llamativo es que entre el 12% y el 19% de los encuestados ha llegado a tener ideas suicidas, principalmente en el periodo en el que la patologÃa no estÃĄ controlada. En ese periplo, mÃĄs del 50% asegura padecer "desesperaciÃģn", un porcentaje que se reduce al 10% tras el diagnÃģstico.
Entre el 12 y el 19% de los pacientes llega a tener ideas suicidas
Algunos participantes hablaron sobre la improvisada ruta asistencial de los enfermos. "Tienen un uso muy recurrente de los servicios sanitarios, tanto en urgencias como en atenciÃģn primaria, y tambiÃĐn en especialistas como dermatÃģlogos o alergÃģlogos, y eso desemboca en duplicidades y en falta de coordinaciÃģn", comentÃģ JÃĄuregui.
Aunque, desde su punto de vista, este proceso ha mejorado en los Últimos aÃąos. "Contamos con dos herramientas fundamentales: por un lado, unas guÃas de prÃĄctica clÃnica que permiten que los profesionales sanitarios hablemos en el mismo idioma; por otro, la historia clÃnica electrÃģnica y la interconsulta no presencial nos permite tener un contacto mÃĄs directo entre primaria y urgencias".
No obstante, la portavoz de la AAUC asegurÃģ que, hasta que se consigue un diagnÃģstico y tratamiento eficaz, el paciente se siente como "una peonza, porque va dando vueltas de un lado a otro, incluyendo varias visitas a urgencias, con la esperanza de dar con un mÃĐdico que le dÃĐ una soluciÃģn. Y eso supone un gran gasto para la sanidad pÚblica".
Por otra parte, Esther Serra aÃąadiÃģ que esta prÃĄctica, una tÃģnica generalizada en los pacientes, no es especialmente Útil. "En urgencias se confunde a menudo con una alergia alimentaria. De esta manera el paciente va a parar a otro saco que no es el adecuado", comentÃģ. Y aÃąadiÃģ: "Si en primaria tuviÃĐramos unidades de alergologÃa o suficientes dermatÃģlogos podrÃamos controlar mucho mÃĄs rÃĄpido la enfermedad. En general, necesitamos mayores recursos en primaria, sobre todo enfocados a patologÃas dermatolÃģgicas".
Una vez que se ha diagnosticado, el objetivo tanto del paciente como del mÃĐdico es conseguir el control total y reducir a cero los sÃntomas. "Hay trabajos que comparan el impacto que tiene el abordaje de la urticaria crÃģnica en la calidad de vida, el trabajo, el sueÃąo y otras actividades de ocio. Cuando se alcanzaba el control total de los sÃntomas, se obtenÃa un 90% de mejorÃa en la calidad de vida. Sin embargo, cuando el control era medio, sÃģlo se obtenÃa un 60%", comentÃģ la especialista del Hospital del Mar.
Nuevas opciones terapÃĐuticas
Para el resto de participantes ÃĐsta es la vÃa mÃĄs adecuada. Y segÚn el informe presentado, los mejores resultados se obtienen con monoterapia. "Los nuevos tratamientos han mejorado muchÃsimo el dÃa a dÃa de los pacientes", puntualizÃģ Esther Serra. Ãsta hizo alusiÃģn al uso de antihistamÃnicos pero tambiÃĐn a los fÃĄrmacos biolÃģgicos, "que estÃĄn sirviendo, ademÃĄs, de ahorro para la sociedad, porque evitan gastos indirectos que pueden surgir del absentismo laboral, anulaciÃģn de viajes, gastos de urgenciasâĶ Lo hemos de ver en globalidad".
No se debe olvidar que la urticaria, en todas sus variantes, es una enfermedad incapacitante en sus picos mÃĄs fuertes. "Es imposible que un paciente acuda a trabajar cuando estÃĄ lleno de ronchas o de angioedema. AdemÃĄs, afecta a sus relaciones sociales y de pareja, y al sueÃąo, porque el paciente no descansa por el picor. La calidad de vida estÃĄ muy daÃąada y por eso es importante llegar al control total de la enfermedad", puntualizÃģ Serra.
Es imposible que un paciente vaya a trabajar cuando estÃĄ lleno de ronchas
A lo largo del encuentro se hablÃģ de la necesidad de tener bien informado al paciente y de desmontar bulos que perjudican seriamente su salud. "En ocasiones el mÃĐdico de primaria sabe de urticaria, la diagnostica bien y pone un buen tratamiento. Pero luego se encuentra con que el paciente no entiende bien por quÃĐ se le ha dado un tratamiento a largo plazo y demanda la opiniÃģn de un especialista. Les cuesta mucho entender que es una patologÃa autoinmune, y convencerse de que lo que tienen no viene de un hÃĄbito que les perjudica o de una contaminaciÃģn ambiental como, por ejemplo, una alergia", asegura GimÃĐnez-Arnau.
Tiempo para escuchar
En opiniÃģn de Marta Ferrer, se suele subestimar el tiempo que hay que dedicarle a un paciente con urticaria. "Parte del tiempo debe destinarse a escuchar, saber cuÃĄles son sus inquietudes, formarle e informarle de forma certera. De otra forma, nos estamos disparando al pie nosotros mismos, porque empujamos al paciente a llamar a otras puertas, que no siempre son las adecuadas, o que atascan el sistema, y encima sin darle una soluciÃģn eficaz".
En esta labor formativa e informativa tiene un importante papel la AAUC, ya que los especialistas sanitarios suelen recomendar a los enfermos que visiten su web o consulten a sus asesores. "Desde la asociaciÃģn, el objetivo bÃĄsico fundacional es difundir y dar a conocer la enfermedad para concienciar a la sociedad y tambiÃĐn para dar informaciÃģn a los pacientes, asà como generar un mayor interÃĐs entre los mÃĐdicos para que profundicen mÃĄs en la materia y la conozcan a fondo", resume Adriana GarcÃa.
La urticaria por frÃo, una de las mÃĄs persistentes a lo largo de la vida, FotoprotecciÃģn y problemas de la piel: guÃa para no perderse, "Debemos crear unidades multidisciplinares para abordar la patologÃa alÃĐrgica compleja"
Al mismo tiempo, este trabajo, supervisado por comitÃĐs cientÃficos, ayuda a quitar el estigma de la enfermedad y evita la expansiÃģn de bulos. "Sirve p
âDiario MÃĐdicoâ ha celebrado un encuentro con pacientes y especialistas de esta enfermedad de difÃcil diagnÃģstico, que en EspaÃąa afecta a unas 300.000 personas.
Off
Gema L. Albendea. Madrid
DermatologÃa
Medicina Familiar y Comunitaria
Off




 Enrique Ordieres, frente a una de las zonas en las instalaciones de Cinfa que dan visibilidad a las personas que conviven con la enfermedad. Foto: ARABA PRESS.
Enrique Ordieres, frente a una de las zonas en las instalaciones de Cinfa que dan visibilidad a las personas que conviven con la enfermedad. Foto: ARABA PRESS.

































 Tejido afectado por un sarcoma.
Tejido afectado por un sarcoma.
 Las instalaciones adquiridas a Catalent se incorporarán al resto de plantas de Novo Nordisk, como la de Kalundborg, en Dinamarca. Foto: NOVO NORDISK.
Las instalaciones adquiridas a Catalent se incorporarán al resto de plantas de Novo Nordisk, como la de Kalundborg, en Dinamarca. Foto: NOVO NORDISK.
 Fachada de la sede del Grupo Italfarmaco en Espaņa. Foto: GRUPO ITALFARMACO.
Fachada de la sede del Grupo Italfarmaco en Espaņa. Foto: GRUPO ITALFARMACO.
 Pfizer acaba de protagonizar la mayor transacción del sector desde 2019 con la adquisición de Seagen por 44.000 millones de dólares. Foto: PFIZER.
Pfizer acaba de protagonizar la mayor transacción del sector desde 2019 con la adquisición de Seagen por 44.000 millones de dólares. Foto: PFIZER.
 Jesús Vidart, director de Acceso de Sandoz Iberia, explica el proyecto 'Salud más Fácil', que adapta prospectos de medicamentos y protocolos para facilitar su comprensión entre personas con discapacidad u otras dificultades comprensivas. Foto: SERGIO GONZÁLEZ.
Jesús Vidart, director de Acceso de Sandoz Iberia, explica el proyecto 'Salud más Fácil', que adapta prospectos de medicamentos y protocolos para facilitar su comprensión entre personas con discapacidad u otras dificultades comprensivas. Foto: SERGIO GONZÁLEZ.
 Jesús Ponce, presidente de Farmaindustria, durante su intervención en la 11 Jornada Somos Pacientes.
Jesús Ponce, presidente de Farmaindustria, durante su intervención en la 11 Jornada Somos Pacientes.
 El desarrollo de una idea innovadora no depende solo del conocimiento y las herramientas, sino tambiÃĐn de variables adicionales que constituyen el principal reto, como la metodologÃa, la financiaciÃģn, la estrategia y la estructura de comercializaciÃģn. Foto: SHUTTERSTOCK/L.ESPARZA.
El desarrollo de una idea innovadora no depende solo del conocimiento y las herramientas, sino tambiÃĐn de variables adicionales que constituyen el principal reto, como la metodologÃa, la financiaciÃģn, la estrategia y la estructura de comercializaciÃģn. Foto: SHUTTERSTOCK/L.ESPARZA.
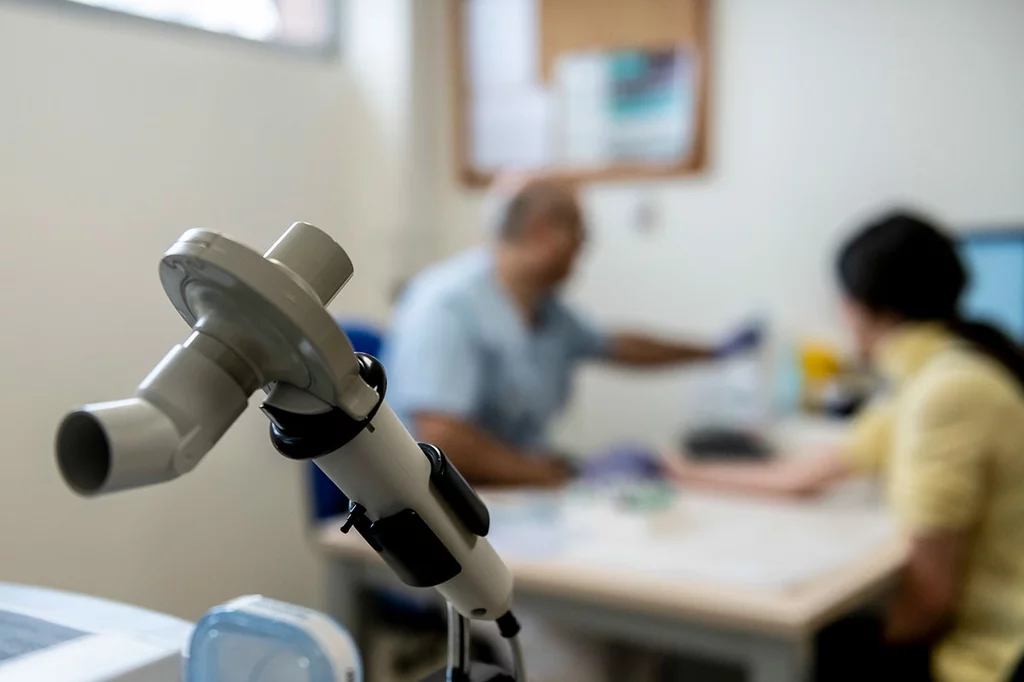 'Tezspire' llega a EspaÃąa como tratamiento de mantenimiento en asma grave no controlada adecuadamente con altas dosis de corticoides inhalados mÃĄs otro medicamento controlador de la enfermedad. Foto: JOSÃ LUIS PINDADO.
'Tezspire' llega a EspaÃąa como tratamiento de mantenimiento en asma grave no controlada adecuadamente con altas dosis de corticoides inhalados mÃĄs otro medicamento controlador de la enfermedad. Foto: JOSÃ LUIS PINDADO.
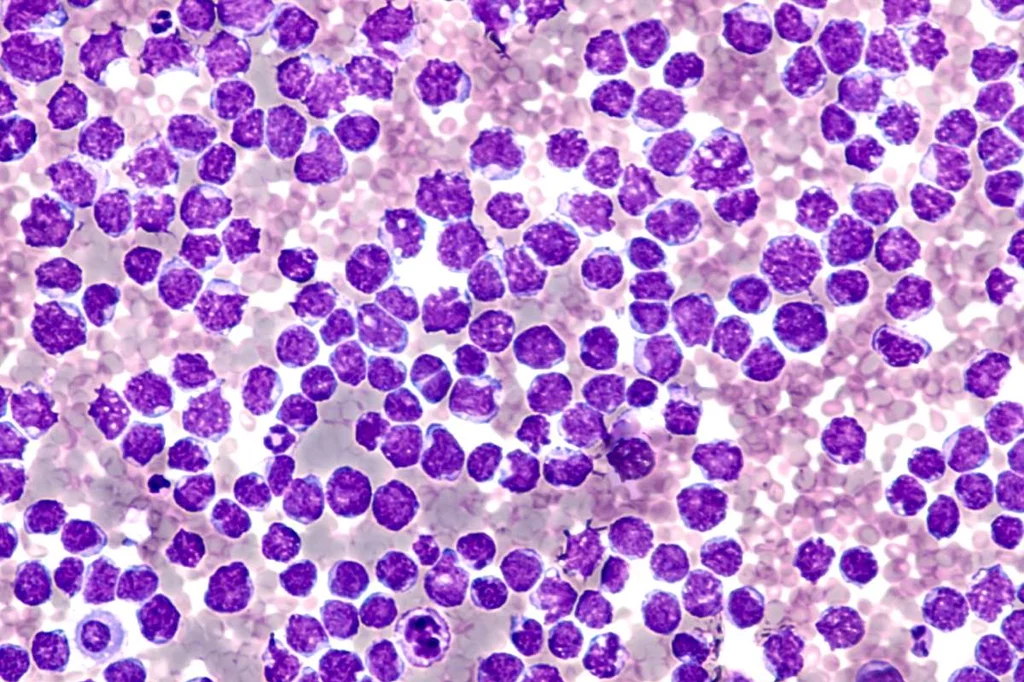 la terapia celular con linfocitos CAR-T ha supuesto una revoluciÃģn para los pacientes con linfoma. Foto: SHUTTERSTOCK
la terapia celular con linfocitos CAR-T ha supuesto una revoluciÃģn para los pacientes con linfoma. Foto: SHUTTERSTOCK
 Raul CÃģrdoba, jefe asociado de HematologÃa y coordinador de la Unidad de Linfomas de la FundaciÃģn JimÃĐnez DÃaz, de Madrid.
Raul CÃģrdoba, jefe asociado de HematologÃa y coordinador de la Unidad de Linfomas de la FundaciÃģn JimÃĐnez DÃaz, de Madrid.
 El medicamento estÃĄ indicado para mejorar no sÃģlo el inicio, mantenimiento y calidad del sueÃąo sino tambiÃĐn su funcionalidad diurna. Foto: SHUTTERSTOCK.
El medicamento estÃĄ indicado para mejorar no sÃģlo el inicio, mantenimiento y calidad del sueÃąo sino tambiÃĐn su funcionalidad diurna. Foto: SHUTTERSTOCK.
 Se extiende entre los responsables sanitarios la conciencia de que la innovaciÃģn y la transformaciÃģn digital son claves en el mantenimiento del sistema pÚblico nacional de salud. Foto: SHUTTERSTOCK/L.ESPARZA.
Se extiende entre los responsables sanitarios la conciencia de que la innovaciÃģn y la transformaciÃģn digital son claves en el mantenimiento del sistema pÚblico nacional de salud. Foto: SHUTTERSTOCK/L.ESPARZA.
 Los pacientes de urticaria crÃģnica tardan una media de tres aÃąos en conseguir un diagnÃģstico. IlustraciÃģn: SHUTTERSTOCK.
Los pacientes de urticaria crÃģnica tardan una media de tres aÃąos en conseguir un diagnÃģstico. IlustraciÃģn: SHUTTERSTOCK.
 MarÃa VictorÃa Mateos, presidenta de la SEHH y la FEHH.
MarÃa VictorÃa Mateos, presidenta de la SEHH y la FEHH.
 Hay mÃĄs de 3.000 centros de salud en EspaÃąa frente a 832 hospitales; hay que aprovecharlo para impulsar la investigaciÃģn clÃnica en ese nivel asistencial. IlustraciÃģn: SHUTTERSTOCK IA.
Hay mÃĄs de 3.000 centros de salud en EspaÃąa frente a 832 hospitales; hay que aprovecharlo para impulsar la investigaciÃģn clÃnica en ese nivel asistencial. IlustraciÃģn: SHUTTERSTOCK IA.
 Daniel Aparicio, director del Ãrea de Salud de Unidad Editorial, en el centro, recoge el premio acompaÃąado de Mariano Provencio, jefe del Servicio de OncologÃa MÃĐdica del Hospital Puerta de Hierro, de Madrid, y Rafael MartÃnez, director de ComunicaciÃģn de Gilead.
Daniel Aparicio, director del Ãrea de Salud de Unidad Editorial, en el centro, recoge el premio acompaÃąado de Mariano Provencio, jefe del Servicio de OncologÃa MÃĐdica del Hospital Puerta de Hierro, de Madrid, y Rafael MartÃnez, director de ComunicaciÃģn de Gilead.
 La medida del Departamento de Salud de Estados Unidos afectarÃĄ al sector de los medicacmentos en todo el paÃs. Foto: SHUTTERSTOCK.
La medida del Departamento de Salud de Estados Unidos afectarÃĄ al sector de los medicacmentos en todo el paÃs. Foto: SHUTTERSTOCK.
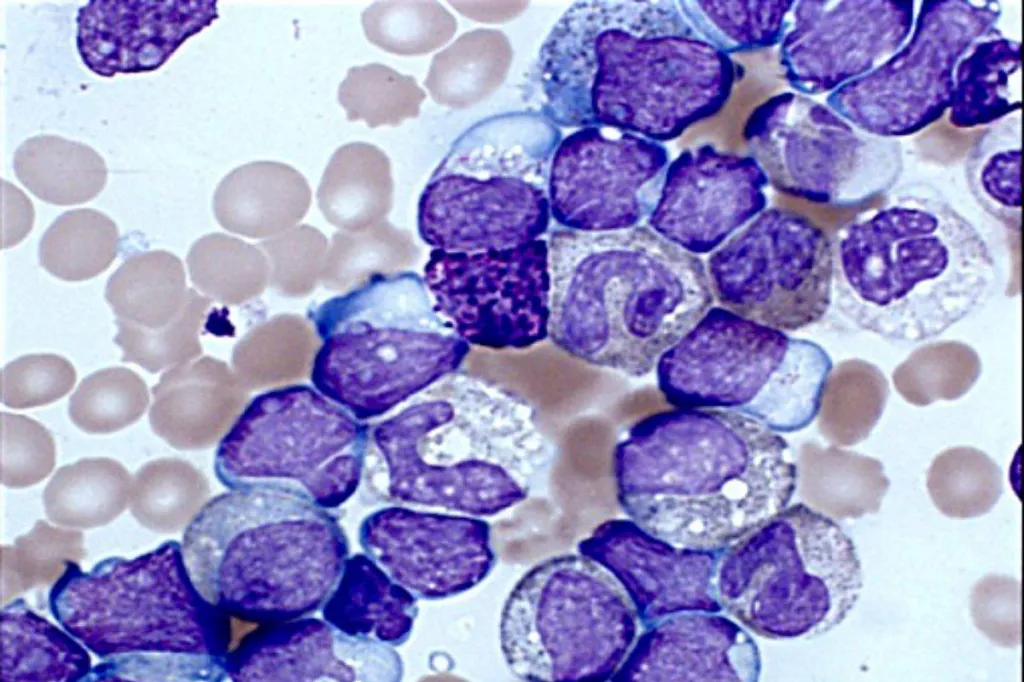 CÃĐlulas de leucemia mieloide aguda.
CÃĐlulas de leucemia mieloide aguda.
 El Co.Lab, de Bayer, ofrece a los emprendedores equipamiento, apoyo tÃĐcnico, mentorizaciÃģn, formaciÃģn e interrelaciÃģn con otros proyectos e investigadores. Foto: BAYER
El Co.Lab, de Bayer, ofrece a los emprendedores equipamiento, apoyo tÃĐcnico, mentorizaciÃģn, formaciÃģn e interrelaciÃģn con otros proyectos e investigadores. Foto: BAYER
 El Broad Institute of MIT and Harvard es una instituciÃģn reconocida internacionalmente en secuenciaciÃģn genÃģmica.
El Broad Institute of MIT and Harvard es una instituciÃģn reconocida internacionalmente en secuenciaciÃģn genÃģmica.
 El BRIC de Bayer, estÃĄ en Kendall Square, la zona de Cambridge (Massachusetts) con mÃĄs biotenolÃģgicas por metro cuadrado. Foto: BAYER
'Incubadora' de investigaciÃģn celular y genÃĐtica
El BRIC de Bayer, estÃĄ en Kendall Square, la zona de Cambridge (Massachusetts) con mÃĄs biotenolÃģgicas por metro cuadrado. Foto: BAYER
'Incubadora' de investigaciÃģn celular y genÃĐtica
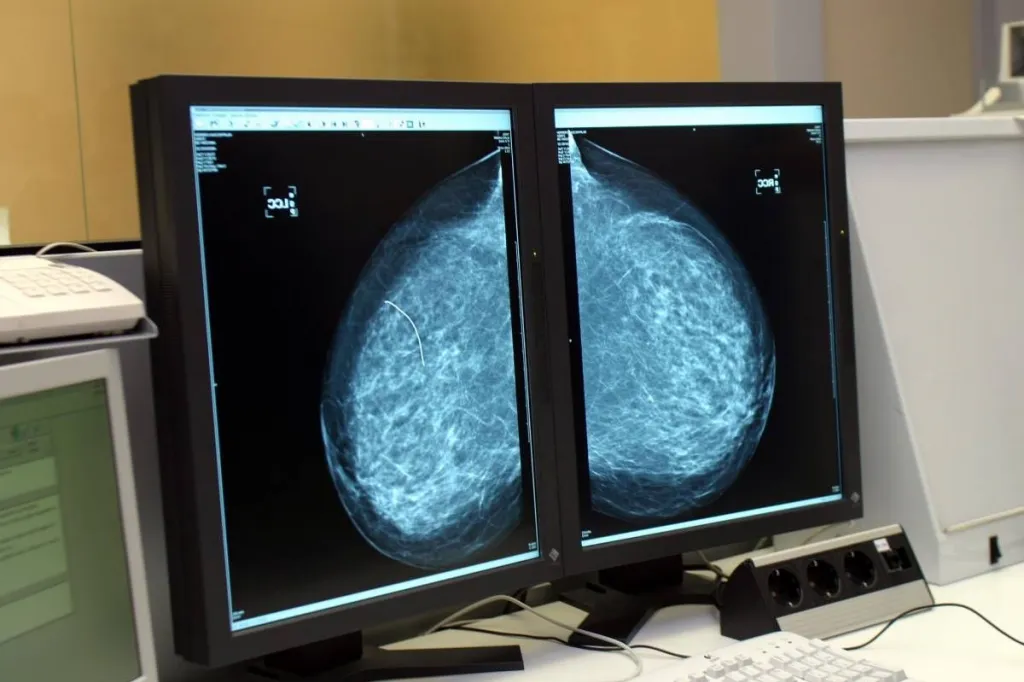 El cÃĄncer de mama serÃĄ uno de los mÃĄs diagnosticados en EspaÃąa en 2023, con 35.001 nuevos casos.
El cÃĄncer de mama serÃĄ uno de los mÃĄs diagnosticados en EspaÃąa en 2023, con 35.001 nuevos casos.
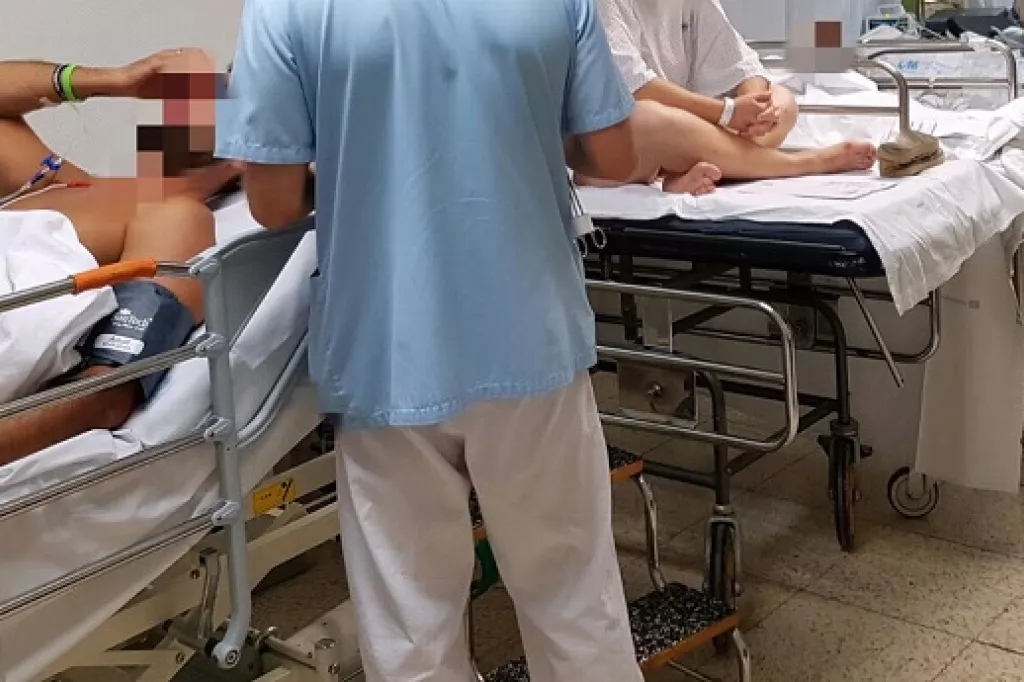 La investigaciÃģn incluyÃģ detalles anonimizados de 30 pacientes tratados en el Servicio de Urgencias del Hospital Jeroen Bosch, de PaÃses Bajos.
La investigaciÃģn incluyÃģ detalles anonimizados de 30 pacientes tratados en el Servicio de Urgencias del Hospital Jeroen Bosch, de PaÃses Bajos.
 SegÚn Francisco Dolz, de Sedisa, la colaboraciÃģn entre directivos y otros profesionales es esencial para aprovechar al mÃĄximo las nuevas tecnologÃas en la atenciÃģn mÃĐdica de calidad. Foto: SHUTTERSTOCK/L.ESPARZA.
SegÚn Francisco Dolz, de Sedisa, la colaboraciÃģn entre directivos y otros profesionales es esencial para aprovechar al mÃĄximo las nuevas tecnologÃas en la atenciÃģn mÃĐdica de calidad. Foto: SHUTTERSTOCK/L.ESPARZA.
 El BRIC estÃĄ especializado en investigaciÃģn en oncologÃa molecular de precisiÃģn. Foto: BAYER
El BRIC estÃĄ especializado en investigaciÃģn en oncologÃa molecular de precisiÃģn. Foto: BAYER
 El Broad Institute of MIT and Harvard, con el que Bayer tiene una intensa colaboraciÃģn en investigaciÃģn oncolÃģgica, es el "instituto lÃder en secuenciaciÃģn genÃģmica", segÚn el director de su Unidad de GenÃģmica del CÃĄncer, Matthew Meyerson.
El Broad Institute of MIT and Harvard, con el que Bayer tiene una intensa colaboraciÃģn en investigaciÃģn oncolÃģgica, es el "instituto lÃder en secuenciaciÃģn genÃģmica", segÚn el director de su Unidad de GenÃģmica del CÃĄncer, Matthew Meyerson.
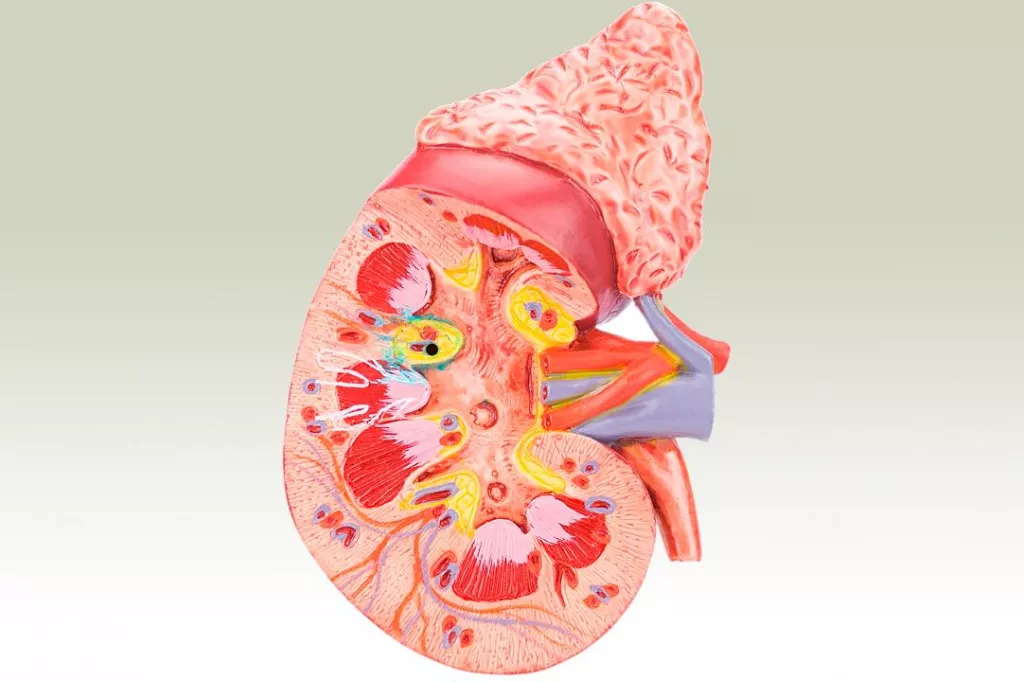 'Jardiance' podrÃa ayudar a controlar los riesgos de enfermedades cardio-renales-metabÃģlicas, a menudo interconectadas, como indican los datos de su uso en diabetes tipo 2 y/o insuficiencia cardiaca.
'Jardiance' podrÃa ayudar a controlar los riesgos de enfermedades cardio-renales-metabÃģlicas, a menudo interconectadas, como indican los datos de su uso en diabetes tipo 2 y/o insuficiencia cardiaca.
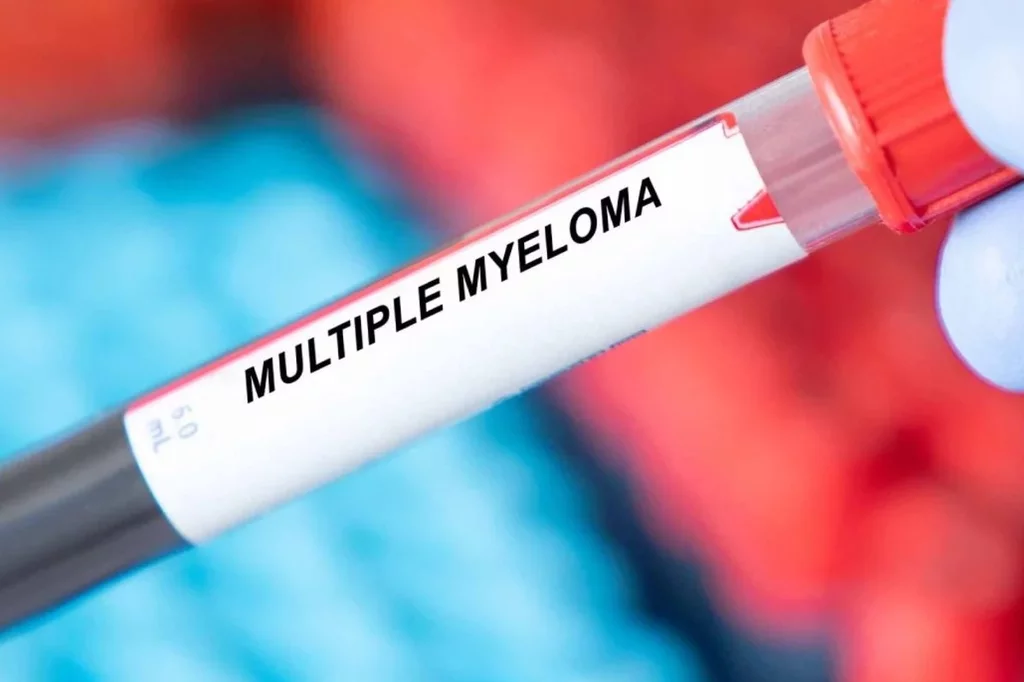 Janssen recibiÃģ hace menos de una semana la aprobaciÃģn de otro anticuerpo biespecÃfico tambiÃĐn indicado en mieloma mÚltiple en recaÃda y refractario.
Janssen recibiÃģ hace menos de una semana la aprobaciÃģn de otro anticuerpo biespecÃfico tambiÃĐn indicado en mieloma mÚltiple en recaÃda y refractario.
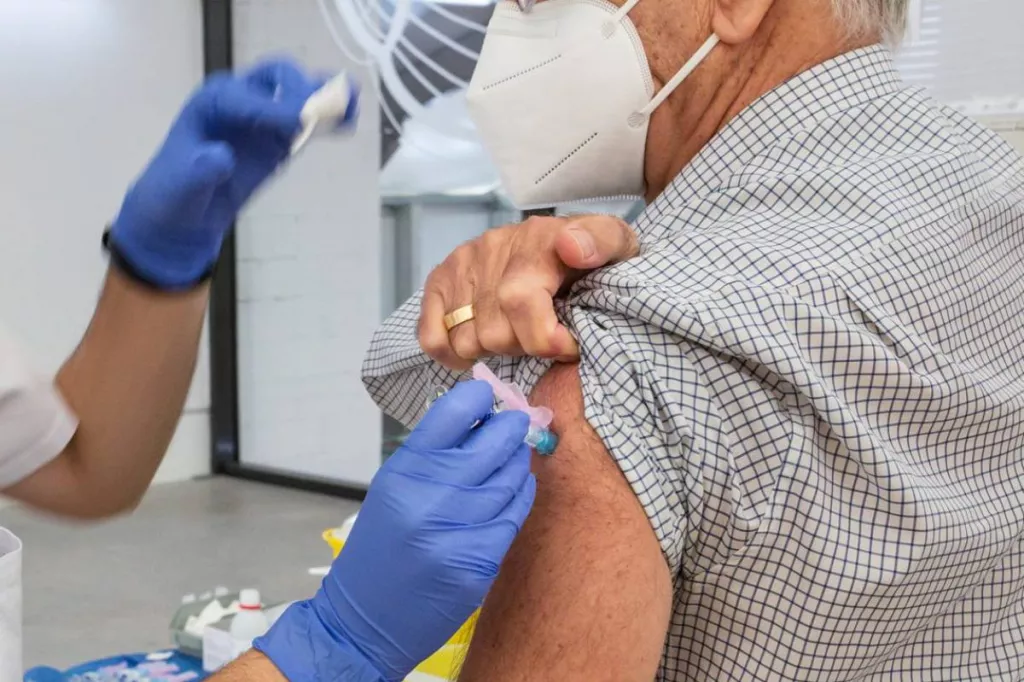 Solo en Estados Unidos, se estima que el VRS es responsable de entre 60.000 y 160.000 muertes y cerca de 10.000 ingresos anuales de personas mayores.
Solo en Estados Unidos, se estima que el VRS es responsable de entre 60.000 y 160.000 muertes y cerca de 10.000 ingresos anuales de personas mayores.
 SegÚn la EMA, los datos de RWE en el entorno europeo proceden generalmente de estudios dirigidos o propiciados por organismos reguladores que se suman a los datos observados en otras fuentes, incluidos los ensayos clÃnicos de las propias farmacÃĐuticas.
SegÚn la EMA, los datos de RWE en el entorno europeo proceden generalmente de estudios dirigidos o propiciados por organismos reguladores que se suman a los datos observados en otras fuentes, incluidos los ensayos clÃnicos de las propias farmacÃĐuticas.
 El estudio comparÃģ el agonista del receptor de GLP-1 frente a placebo como complemento del tratamiento estÃĄndar para la prevenciÃģn de los principales eventos adversos cardiovasculares importantes.
El estudio comparÃģ el agonista del receptor de GLP-1 frente a placebo como complemento del tratamiento estÃĄndar para la prevenciÃģn de los principales eventos adversos cardiovasculares importantes.
 Sanidad ya ha aprobado seis guÃas que establecen las condiciones en las que las enfermeras pueden participar en el uso de medicamentos de prescripciÃģn, entre ellas la de los fÃĄrmacos para la hipertensiÃģn.
Sanidad ya ha aprobado seis guÃas que establecen las condiciones en las que las enfermeras pueden participar en el uso de medicamentos de prescripciÃģn, entre ellas la de los fÃĄrmacos para la hipertensiÃģn.
 JesÚs Ãlvarez Ojeda es Licenciado en Medicina y CirugÃa por la Facultad de Medicina de la Universidad de Zaragoza y Especialista en AnestesiologÃa, ReanimaciÃģn y Tratamiento del Dolor.
JesÚs Ãlvarez Ojeda es Licenciado en Medicina y CirugÃa por la Facultad de Medicina de la Universidad de Zaragoza y Especialista en AnestesiologÃa, ReanimaciÃģn y Tratamiento del Dolor.
 Ciencia computacional, estadÃstica e ingenierÃa emplean algoritmos o modelos para desarrollar procedimientos, reflejar comportamientos, adoptar decisiones y hacer predicciones.
Ciencia computacional, estadÃstica e ingenierÃa emplean algoritmos o modelos para desarrollar procedimientos, reflejar comportamientos, adoptar decisiones y hacer predicciones.
 En EspaÃąa falta un cambio cultural que facilite la transferencia de investigaciÃģn al tejido productivo. Foto: SHUTTERSTOCK/L.ESPARZA.
En EspaÃąa falta un cambio cultural que facilite la transferencia de investigaciÃģn al tejido productivo. Foto: SHUTTERSTOCK/L.ESPARZA.
 Christina Vega sustituirÃĄ al frente de Lilly EspaÃąa, Portugal y Grecia a Nabil Daoud, quien pasarÃĄ a ser vicepresidente sÃĐnior de Marketing de la multinacional estadounidense. FOTO: LILLY
Christina Vega sustituirÃĄ al frente de Lilly EspaÃąa, Portugal y Grecia a Nabil Daoud, quien pasarÃĄ a ser vicepresidente sÃĐnior de Marketing de la multinacional estadounidense. FOTO: LILLY
 Luis Esgueva, director general de Glintt EspaÃąa. Foto: SERGIO GONZÃLEZ VALERO.
Luis Esgueva, director general de Glintt EspaÃąa. Foto: SERGIO GONZÃLEZ VALERO.
 La directora de la cÃĄtedra, MarÃa Luisa Lozano, expone sus objetivos al consejero de Salud, rector y miembros de su equipo.
La directora de la cÃĄtedra, MarÃa Luisa Lozano, expone sus objetivos al consejero de Salud, rector y miembros de su equipo.
 Carlos Vilar Fabra, jefe de SecciÃģn de NeurologÃa en el Hospital General Universitario de CastellÃģn (HGUC), ha sido proclamado nuevo presidente del Colegio de MÃĐdicos de CastellÃģn (Comcas). Foto: CCOMCAS.
Carlos Vilar Fabra, jefe de SecciÃģn de NeurologÃa en el Hospital General Universitario de CastellÃģn (HGUC), ha sido proclamado nuevo presidente del Colegio de MÃĐdicos de CastellÃģn (Comcas). Foto: CCOMCAS.
 Manuela GarcÃa Romero.
Manuela GarcÃa Romero.
 JesÚs FernÃĄndez Sanz continÚa al frente de la ConsejerÃa de Sanidad de Castilla-La Mancha. Foto: DM.
JesÚs FernÃĄndez Sanz continÚa al frente de la ConsejerÃa de Sanidad de Castilla-La Mancha. Foto: DM.
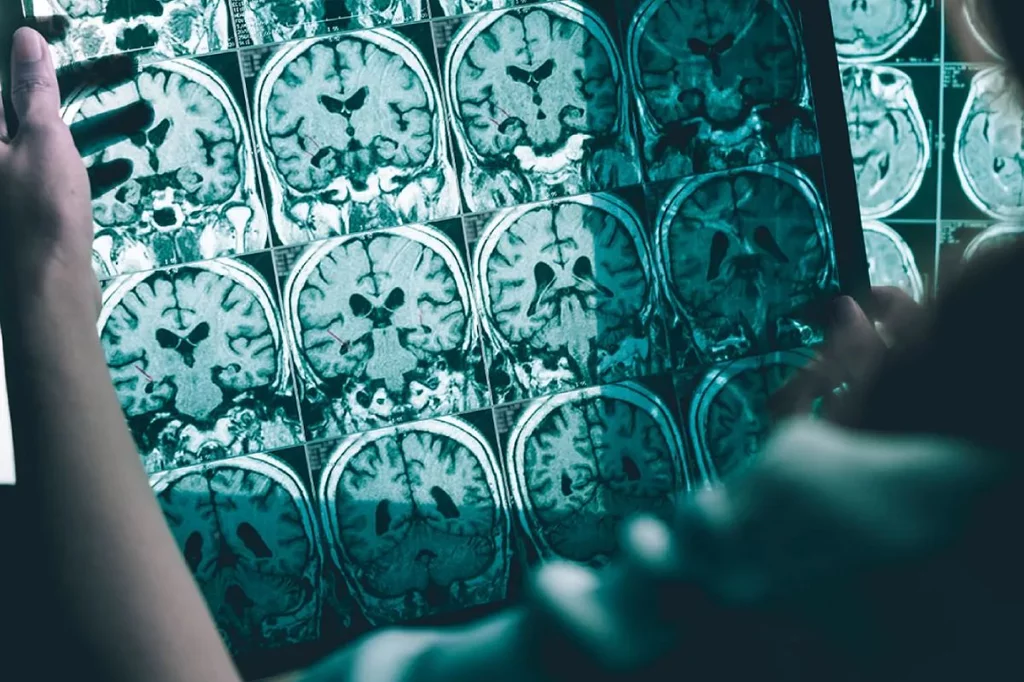 Lecanemab-irmb actÚa reduciendo las placas de la proteÃna amiloide del cerebro, que constituyen un rasgo patofisiolÃģgico de la enfermedad.
Lecanemab-irmb actÚa reduciendo las placas de la proteÃna amiloide del cerebro, que constituyen un rasgo patofisiolÃģgico de la enfermedad.
 Promover la innovaciÃģn y el emprendimiento en salud son algunos de los objetivos del EIT (Instituto Europeo de InnovaciÃģn y TecnologÃa) Health Spain, de ahà su apoyo al 'Ennova Health Day' de 'Diario MÃĐdico' y 'Correo FarmacÃĐutico'.
Promover la innovaciÃģn y el emprendimiento en salud son algunos de los objetivos del EIT (Instituto Europeo de InnovaciÃģn y TecnologÃa) Health Spain, de ahà su apoyo al 'Ennova Health Day' de 'Diario MÃĐdico' y 'Correo FarmacÃĐutico'.
 CÃĐlulas metastÃĄsicas de cÃĄncer de mama.
CÃĐlulas metastÃĄsicas de cÃĄncer de mama.
 Ilya Yuffa, vicepresidente ejecutivo de Lilly y presidente del Ãrea Internacional de la compaÃąÃa. Foto: SERGIO GONZÃLEZ VALERO.
Ilya Yuffa, vicepresidente ejecutivo de Lilly y presidente del Ãrea Internacional de la compaÃąÃa. Foto: SERGIO GONZÃLEZ VALERO.
 Cristina Bas, directora mÃĄdico de BeiGene EspaÃąa y Portugal; Patricia Baltasar, hematÃģloga del Hospital La Paz, de Madrid; Cristina GarcÃa Medinilla, directora general de BeiGene EspaÃąa y Portugal, y Antonio Salar, hematÃģlogo del Hospital Virgen de la Arrixaca, de Murcia.
Cristina Bas, directora mÃĄdico de BeiGene EspaÃąa y Portugal; Patricia Baltasar, hematÃģloga del Hospital La Paz, de Madrid; Cristina GarcÃa Medinilla, directora general de BeiGene EspaÃąa y Portugal, y Antonio Salar, hematÃģlogo del Hospital Virgen de la Arrixaca, de Murcia.
 El 75% de los casos se diagnostica en fase avanzada, en la que el tratamiento no ofrece garantÃa de curaciÃģn. IlustraciÃģn: SHUTTERSTOCK IA.
El 75% de los casos se diagnostica en fase avanzada, en la que el tratamiento no ofrece garantÃa de curaciÃģn. IlustraciÃģn: SHUTTERSTOCK IA.
 Iker JimÃĐnez. Periodista, director y presentador del programa âCuarto Milenioâ, de Cuatro.
Iker JimÃĐnez. Periodista, director y presentador del programa âCuarto Milenioâ, de Cuatro.
 Algunas patologÃas neurolÃģgicas y psiquiÃĄtricas, como el PÃĄrkinson y la esquizofrenia, estÃĄn entre las que mÃĄs se pueden beneficiar de la innovaciÃģn incremental de medicamentos.
Algunas patologÃas neurolÃģgicas y psiquiÃĄtricas, como el PÃĄrkinson y la esquizofrenia, estÃĄn entre las que mÃĄs se pueden beneficiar de la innovaciÃģn incremental de medicamentos.
 ValentÃn Ortiz-Maldonado. Servicio de HematologÃa del Hospital ClÃnic de Barcelona.
ValentÃn Ortiz-Maldonado. Servicio de HematologÃa del Hospital ClÃnic de Barcelona.
 JoaquÃn Rodrigo, director general de Sandoz EspaÃąa. Foto: SERGIO ENRÃQUEZ.
JoaquÃn Rodrigo, director general de Sandoz EspaÃąa. Foto: SERGIO ENRÃQUEZ.
 Viales en el Laboratorio de Sanidad Animal de Algete, uno de los de referencia de gripe aviar de EspaÃąa. Foto: ÃNGEL NAVARRETE.
Viales en el Laboratorio de Sanidad Animal de Algete, uno de los de referencia de gripe aviar de EspaÃąa. Foto: ÃNGEL NAVARRETE.
 Diego Murillo, presidente de la FundaciÃģn AMA.
Diego Murillo, presidente de la FundaciÃģn AMA.
 Antonio Mingorance, presidente de Bidafarma. Foto: SERGIO GONZÃLEZ VALERO.
Antonio Mingorance, presidente de Bidafarma. Foto: SERGIO GONZÃLEZ VALERO.
 Mar FÃĄbregas, directora general de Stada EspaÃąa. Foto: ARABA PRESS/PEDRO SALADO.
Mar FÃĄbregas, directora general de Stada EspaÃąa. Foto: ARABA PRESS/PEDRO SALADO.