PolÃtica y Normativa
manuelbustelo
Sáb, 12/06/2021 - 08:00
Entrevista: MarÃa Jesús Lamas

MarÃa Jesús Lamas, directora de la Agencia Española de Medicamentos y Productos Sanitarios.
Incesante. Sin horarios. En ocasiones, no exenta de riesgo. Son muchos los vocablos y expresiones que podrÃan definir la inmensa labor que está desempeñando la Agencia Española de Medicamentos y Productos Sanitarios (Aemps) para combatir la pandemia de la covid-19. Todo ese trabajo, tal y como defiende su directora, MarÃa Jesús Lamas, no serÃa posible sin el esfuerzo y el compromiso de todos los profesionales que la integran. De hecho, son el motor que ha permitido llevar a cabo todas las tareas ligadas a aspectos como la gestión de medicamentos, el control de ensayos clÃnicos, el proceso de adquisición de vacunas y las labores de farmacovigilancia de las mismas.
Por todo ello, Lamas, como máxima representante de esta institución, ha sido galardonada con uno de los Premios Admirables que conceden Diario Médico y Correo Farmacéutico.
Pregunta. La pandemia ha dado un giro de 180º a la actividad diaria de la Aemps. ¿Cómo se han ido viviendo todos esos cambios?
Respuesta. Reconozco que hay matices que me cuesta recordar. Ha sido todo tan intenso que lo que pasó hace un año me parece que ocurrió hace muchÃsimo más. Pero sà que recuerdo momentos de mucha tensión, siempre con la sensación de que controlábamos lo que estábamos haciendo, pero con un riesgo enorme. Y también recuerdo sensación de vértigo: trabajábamos con la idea de que lo que estábamos haciendo iba a ser suficiente para la próximas 24 horas, pero sin saber si iba a ser suficiente para las siguientes 48. Detrás de ese vértigo, por supuesto, estaban los pacientes (los ingresados en las UCI fundamentalmente) y la sensación de que muchas vidas dependÃan de lo que nosotros hiciéramos.Â
P. ¿Qué aspectos de toda esta metamorfosis destaca especialmente?
R. Me quedo con la capacidad de adaptación que hemos tenido y con el factor humano. Esto no hubiera sido posible sin la gente que forma parte del equipo directivo, seguida del resto de personas responsables hacia abajo hasta llegar al último empleado que se haya incorporado. Sin todos ellos no hubiéramos sido capaces de ver que era necesario salir de nuestro espacio habitual, explorar espacios nuevos y arriesgarnos. Nos hemos arriesgado, hemos asumido funciones que no eran habitualmente las nuestras sin ninguna garantÃa de que pudieran tener éxito, pero lo que sà sabÃamos es que no arriesgarse ya era un fracaso en sà mismo.
P. ¿Cómo se trabajó para garantizar en los hospitales la disponibilidad de medicamentos esenciales?
R. En una sala que tenemos aquÃ, en la sede de la Aemps, colgábamos todos los dÃas esquemas con la evolución de los pacientes ingresados en cama ordinaria y en UCI. Trabajábamos con los protocolos terapéuticos habituales y con los alternativos por si fallaba la medicación de los protocolos habituales; hicimos las dosis diarias definidas (DDD) necesarias de cada uno de los medicamentos y calculábamos, con toda la producción que habÃa en España, para cuántas horas nos llegaba. Era una sensación de vértigo.
P. Imagino que no serÃa una tarea fácil...
R. Pues no, porque al mismo tiempo habÃa que tener mucha sangre frÃa. Por ejemplo, pasó con la hidroxicloroquina. Cuando todavÃa parecÃa que la hidroxicloroquina podÃa tener un papel importante en el control de la covid, era fácil hacer números y ver que, con las producciones mundiales y con cómo estaba aumentando el número de infectados, no iba a llegar. Entonces se desató el comercio mundial y la fiebre por conseguir hidroxicloroquina. Muchos intermediarios nos llamaban y nos ofrecÃan donaciones o ventas de producto que habÃan comprado en determinadas condiciones. Y ahà fue un momento en el que nosotros nunca perdimos el control. TenÃamos contacto con nuestros colegas de todos los paÃses, a través sobre todo de los inspectores de normas de correcta fabricación de las plantas, y por eso tenÃamos un acceso directo a las plantas de producción de los principios activos que estábamos necesitando aquÃ.
También necesitamos pedir cobertura al Ministerio de Exteriores y al Ministerio de Industria porque tuvimos que pedir la implicación de algunas de las plantas que fabrican principios activos (por ejemplo, cisatracurio) y necesitábamos una mediación, ya que nunca habÃamos hecho una compra internacional directamente con una planta de principio activo.
P. ¿Cómo se trabajó para garantizar en los centros hospitalarios el abastecimiento de esos fármacos esenciales?
R. Por una parte hicimos una distribución controlada de todos los medicamentos para abastecer las UCI, porque se estaban fabricando en continuo principio activo y medicamento, y se estaba distribuyendo según se fabricaba el medicamento finalizado. Si se hubiera seguido un sistema de distribución normal, habrÃa colapsado. SabÃamos que si esto salÃa mal, los culpables de que los hospitales no tuviesen medicamentos serÃamos nosotros, pero también sabÃamos que si no lo hacÃamos también Ãbamos a ser responsables de esa falta de medicación. Asà que asumimos la responsabilidad.
Por otra parte, habÃa medicamentos con los que tenÃamos un control individualizado y habÃa que pedirlos vÃa solicitud. EntendÃamos que esto a los hospitales les podÃa suponer una carga añadida de trabajo -que intentamos que fuese la mÃnima-, pero también lo supuso para la agencia, porque una ventanilla que tenÃa una actividad enfocada al procedimiento, y no a la evaluación clÃnica, en horario de oficina, se convirtió en una puerta de solicitudes que tenÃa que hacer evaluación clÃnica y que trabajaba 24/7.
P. Otra labor de la Aemps durante los primeros meses de la pandemia fue controlar todos los ensayos clÃnicos que se pusieron en marcha. Fueron muchos. ¿HabrÃa sido mejor que hubiese habido más unificación?
R. Todo hay que verlo en perspectiva. Es cierto que en junio [de 2020] habÃa más de 100 ensayos clÃnicos, pero lo primero que hay que hacer es agradecer a todos los que se pusieron al frente de estos ensayos clÃnicos su iniciativa. Nunca antes han vivido en los hospitales sobrecargas asistenciales tan importantes como las que vivieron en ese momento (con los profesionales trabajando al lÃmite, arriesgando su salud y con jornadas interminables) y al mismo tiempo tuvieron la sensatez de que todo lo que hicieron lo metieron dentro de protocolos de investigación que permitieran extraer conclusiones, comparar y reproducir. La parte positiva de todo esto es tan potente, que todo lo demás hay que cogerlo en la medida en que corresponde. Hay que analizar qué se pudo hacer mejor, pero sabiendo que lo que se ha hecho ha sido maravilloso.
P. ¿Y que cree se pudo haber hecho mejor?
R. Pues algo que no es fácil: tener un menor número de ensayos clÃnicos -ya que muchos de ellos eran muy parecidos entre sÃ- y haber tenido un único protocolo maestro para la mayorÃa de las terapias y que de ese protocolo maestro cayeran todos los ensayos clÃnicos. Al principio intentamos conseguirlo, pero cuando vimos que hacer eso suponÃa retrasar el inicio de los ensayos clÃnicos, o incluso perder centros hospitalarios que podrÃan entrar dentro de ensayos clÃnicos, pensamos en ese momento que no era la forma de hacerlo.

[http%3A%2F%2Fwww.w3.org%2F2000%2Fsvg'%20viewBox%3D'0%200%201200%20800'%2F%3E"] />MarÃa Jesús Lamas, durante la entrevista con este periódico en la sede de la Aemps, en Madrid. (Mauricio Skrycky)
P. Imagino que, en la generación de evidencia, un hándicap añadido por la pandemia serÃa el tener que evaluar esa evidencia a un ritmo más rápido del habitual, ¿no?
R. Nosotros en esto creo que mantuvimos la sensatez. HabÃa una necesidad absoluta de generar evidencia cientÃfica y las plataforma de preprint se llenaron de artÃculos de dudoso valor cientÃfico. Esto se recogÃa por los medios, no solo especializados, sino también generalistas, porque no habÃa más noticia que la covid. Estaba todo el mundo encerrado en su casa y solo se hablaba de la enfermedad y de todo lo que estuviera a su alrededor. Noticias que de forma habitual son de ámbito cientÃfico y que llegan a un sector muy limitado, se convirtieron en noticias de sobremesa y de tertulia. Y eso parece que ayudó a extender algunas conclusiones de estudios que eran bastante dudosas. La verdad es que desde aquà siempre los hemos visto con las limitaciones que tenÃan. Todo lo que se iba publicando lo Ãbamos leyendo y, de todo lo que Ãbamos leyendo, sabÃamos qué podrÃa tener peso y qué habÃa que poner bajo estricta cuarentena, porque tenÃa muy poca validez. Es algo de lo que también hemos aprendido.
P. En cuanto a las vacunas, ¿qué papel ha jugado la Aemps en el proceso de compra?
R. La agencia ha tenido un papel protagonista en la compra de las vacunas desde el principio, porque hemos salido a buscar los ensayos clÃnicos. Ahora parece que siempre supimos que Ãbamos a tener vacuna, pero hace un año las estimaciones más optimistas decÃan que la vacuna podrÃa llegar en 18 meses, lo cual fechaba su llegada en junio-julio de 2021; y lo importante era generar evidencia rápido y tener ensayos clÃnicos. Nosotros, en mayo del año pasado, empezamos a llamar a las compañÃas a sus sedes globales. Hablamos con los grandes productores de vacunas (Sanofi, MSD, Moderna, Johnson&Johnson, Pfizer...) para conocer el estado de desarrollo de las vacunas y cuál era su plan de investigación clÃnica, y les dijimos que contaran con España para incluirla dentro de ese plan de investigación clÃnica.
P. ¿Era un objetivo clave para la Aemps que se contase con España dentro de esas estrategias de investigación clÃnica?
R. SÃ, por muchos motivos evidentes. Sabemos bien por qué nos interesa traer ensayos clÃnicos a España: supone un acceso precoz al medicamento, una formación precoz de los profesionales sanitarios, una ganancia de experiencia... y en este caso habÃa un claro beneficio si podÃamos empezar a vacunar dentro de protocolos de ensayos clÃnicos.
P. Y en la evaluación de las vacunas, ¿qué rol ha tenido la Aemps?
R. La evaluación de las vacunas está centralizada por la Agencia Europea del Medicamento (EMA), pero se hace por comités donde están representadas las agencias nacionales, y nuestros evaluadores son ponentes o coponentes de tres de las cuatro vacunas autorizadas. Hemos tenido un papel protagonista.
P. También ha habido participación de la agencia en el comité director de la estrategia europea de vacunas y en el grupo de negociación conjunta, ¿verdad?
R. Asà es. En su momento, el entonces ministro de Sanidad, Salvador Illa, nos pidió a César Hernández [jefe del Departamento de Medicamentos de Uso Humano de la Aemps] y a mÃ, que participáramos y representáramos a España en el comité director de la estrategia europea de vacunas y en el grupo de negociación conjunta con otros cinco Estados miembros y la Comisión Europea. Y creo que la aventura europea de acceso a la vacuna es un verdadero éxito, que no se ha contado bien, y hay que tener la paciencia de esperar a que pase el tiempo para que quienes han pensado que Europa va muy lento y ha fallado, rectifiquen y se den cuenta de ese éxito.
P. ¿Cuáles son, a su juicio, los principales argumentos que avalan ese éxito?
R. Hay que pensar que en toda Europa llevamos un ritmo de vacunación muy parecido. Y también hay que ver que Europa es la única región que tiene cuatro vacunas autorizadas para su comercialización, con lo que esto supone de obligaciones para el titular de comercialización y de seguridad para el ciudadano. Reino Unido o Estados Unidos no tienen ni tantas, ni autorizadas para su comercialización; tienen autorizaciones de uso de emergencia, que no es exactamente lo mismo. Asà que creo que hay que verlo como un éxito. Y además, es la única región que no ha hecho nacionalismo de vacunas: se ha entendido que si la vacunación no es global y no beneficia a todo el planeta, no nos beneficia a ninguno; porque mientras existan zonas en las que el virus circule ampliamente y no tengan protección inmunológica, la posibilidad de que aparezcan variantes que nos amenacen a todos existe, y eso hay que controlarlo.
Por este motivo, Europa, en el documento de acuerdo entre los Estados miembros y la Comisión Europea para iniciar la estrategia conjunta, señala que la vacuna es un bien público; y por eso está encaminada a incrementar la capacidad de producción de las compañÃas, para que pueda vacunarse la población europea y el resto de la población mundial. Además, también dice que la estrategia de compra debe favorecer la vacunación europea, y la reventa o donación a otras regiones.
P. En España, ¿qué papel juega la agencia en la estrategia de vacunación?
R. La estrategia se basa en los documentos técnicos que elabora la Ponencia de Vacunas y nuestros expertos, tanto evaluadores como de farmacovigilancia, asesoran y forman parte de la misma. La ponencia, de forma periódica, revisa la evidencia que se va generando, tanto en ensayos clÃnicos como en estudios de vida real, sopesando los datos de seguridad y de farmacovigilancia que les aportan nuestros técnicos, y recomendando el posicionamiento de las vacunas en función de la evidencia que se va generando.
Lo que ha pretendido la ponencia durante todo este tiempo no es evaluar vacuna a vacuna, porque esto ya lo hace la Agencia Europea del Medicamento con la participación de las agencias nacionales, sino adaptar la vacunación para obtener el mayor beneficio y el menor riesgo. Y con ese objetivo es con el que se ha ido posicionando cada una de las vacunas dentro de la estrategia de vacunación en distintos grupos etarios o poblacionales.
P. En las labores de farmacovigilancia, ¿entiendo que el trabajo en los últimos meses habrá sido frenético?
R. En farmacovigilancia también hemos tenido un papel protagonista. Recuerdo cuando comenzaron a conocerse los casos de trombosis y no se sabÃa qué dimensión iba a tener el asunto. El papel de nuestros técnicos de farmacovigilancia ha sido determinante: desde el principio, con los datos y en comunicación con el resto de agencias, tuvimos encima de la mesa la comparación de casos observados versus casos esperados, lo que nos permitió analizar la situación.
P. El hecho de que estemos ante una vacunación masiva que implica inmunizar a toda la población en poco tiempo, ¿dificulta la labor de farmacovigilancia?
R. La diferencia de estas vacunas con cualquier otro medicamento que se haya autorizado nunca es que su uso ha sido masivo y creciente inmediatamente después de ser autorizada, con lo cual ya sabÃamos que iban a aparecer efectos adversos rápido. Sin embargo, hay que tener cuidado, porque algunas de las conclusiones que se obtienen hay que contextualizarlas en el grupo que está recibiendo la vacuna.
P. A fecha de hoy, son cinco los informes de farmacovigilancia que se han emitido desde la Aemps sobre las vacunas. ¿Se han destinado más recursos a esta labor?
R. Las labores de farmacovigilancia se están reforzando dedicándole más tiempo, porque lamentablemente no se pueden destinar más recursos porque la agencia es una entidad estatal cuya gestión de personal obedece a las normas de la función pública, con sus rigideces y con sus carriles de acceso bien establecidos, lo que supone una limitación para responder a una demanda ingente de trabajo. Nos movemos con las posibilidades que nos da la función pública. Dentro de la agencia hemos tratado de reubicar personal y fortalecer los sitios que más demanda tienen. En estos sitios, si está saliendo el trabajo, es por el compromiso personal de sus profesionales y porque ninguno de ellos trabaja con horarios.
P. ¿Cree que esto es algo que la pandemia ha puesto sobre la mesa y que deberÃa revisarse de cara al futuro?
R. Se necesita que organismos cientÃfico-técnicos como la agencia tengan la capacidad y la flexibilidad de, en momentos como el que estamos viviendo, poder dotarse de talento, de conocimiento y de perfiles muy especÃficos. De hecho, veo con alegrÃa que el Ministerio de PolÃtica Territorial y Función Pública esté empezando a trabajar en redefinir la función pública del futuro. Creo que es algo muy necesario, ya que organismos como el nuestro necesitan, en general, beneficiarse de esa renovación de la función pública y, en particular, tener una mayor flexibilidad en la gestión de personal.
P. Por último, me gustarÃa preguntarle sobre cómo se ha vivido desde la agencia la estrecha relación que ha habido entre la Administración y los profesionales sanitarios durante la pandemia.
R. Esa relación nos ha dado mucha seguridad y se ha intensificado con la pandemia, aunque siempre habÃamos tenido contactos (formales e informales) con profesionales sanitarios y con sociedades cientÃficas. Era muy habitual que en la agencia, ante una duda, hasta en la evaluación de un medicamento, se pudiera pedir una opinión de un experto externo.
Y luego también hay una parte emocional que se produjo sobre todo en los meses que peor se pasó, en la primera ola, que fue que algunos de los médicos y farmacéuticos de hospital con los que hablábamos a diario para la elaboración de protocolos de ensayos clÃnicos y para comprobar con ellos la idoneidad o no de incluir dentro las guÃas determinados tratamientos, cada pocos dÃas nos iban contando cuándo uno de ellos habÃa caÃdo enfermo, cuándo ya no se iba a conectar a la siguiente reunión y quién iba a sustituirlo. Fueron momentos duros.
La directora de la Aemps destaca el intenso trabajo que está realizando su equipo para coordinar, gestionar y controlar las diversas tareas destinadas a combatir la pandemia de la covid-19.
Admirables
Admirables
Off
Manuel F. Bustelo
PolÃtica y Normativa
PolÃtica y Normativa
PolÃtica y Normativa
Off
 Pacientes haciendo cola frente al centro de salud Legazpi, en Madrid (José Luis Pindado)
Pacientes haciendo cola frente al centro de salud Legazpi, en Madrid (José Luis Pindado)


 César Casado, Walter Alabarcez, Daniel Prefasi y Angelica Portaña, el valor de las tecnologÃas inmersivas en la atención médica
César Casado, Walter Alabarcez, Daniel Prefasi y Angelica Portaña, el valor de las tecnologÃas inmersivas en la atención médica
 El virólogo Luis Enjuanes ha participado en el Congreso de la Sociedad Española de Diabetes. FOTO: DM.
El virólogo Luis Enjuanes ha participado en el Congreso de la Sociedad Española de Diabetes. FOTO: DM.
 Maria José GarcÃa, presidenta de Fefga y vicepresidenta de FEFE.
Maria José GarcÃa, presidenta de Fefga y vicepresidenta de FEFE.
 El Consejo General de EnfermerÃa (CGE), la Sociedad Española de EnfermerÃa Experta en Estomaterapia (SEDE) y la empresa Coloplast han puesto en marcha la campaña nacional ‘Disfruta del verano también con ostomÃa’, para ofrecer a los pacientes consejos y ayuda en esta época del año.
El Consejo General de EnfermerÃa (CGE), la Sociedad Española de EnfermerÃa Experta en Estomaterapia (SEDE) y la empresa Coloplast han puesto en marcha la campaña nacional ‘Disfruta del verano también con ostomÃa’, para ofrecer a los pacientes consejos y ayuda en esta época del año.
 Las enfermeras estomaterapeutas han preparado una infografÃa con consejos para hacer más llevadero el verano a las personas ostomizadas.
Las enfermeras estomaterapeutas han preparado una infografÃa con consejos para hacer más llevadero el verano a las personas ostomizadas.
 Santiago Ramón y Cajal publicó en 1921 el libro 'Charlas de café'.
Santiago Ramón y Cajal publicó en 1921 el libro 'Charlas de café'.
 Olivia Ferrández, Sant Grau, Elena MartÃn-GarcÃa, Rafael Maldonado, firmantes del estudio. Foto: Hospital del Mar
Olivia Ferrández, Sant Grau, Elena MartÃn-GarcÃa, Rafael Maldonado, firmantes del estudio. Foto: Hospital del Mar
 Manuel Puga, presidente de la Real Academia de Farmacia de Galicia, hace entrega del I Premio Perfecto Feijóo a Jesús Aguilar, presidente del Consejo General de COF, como representante de toda la profesión farmacéutica.
Manuel Puga, presidente de la Real Academia de Farmacia de Galicia, hace entrega del I Premio Perfecto Feijóo a Jesús Aguilar, presidente del Consejo General de COF, como representante de toda la profesión farmacéutica.
 Un grupo de manifestantes frente al Ministerio de Sanidad (Foto: José Luis Pindado)
Un grupo de manifestantes frente al Ministerio de Sanidad (Foto: José Luis Pindado)
 Lydia López Manzanares, Eduardo GarcÃa Navarrete, José Antonio Fernández Alen, José Vivancos Mora, Cristina V. Torres DÃaz y Marta Navas GarcÃa, del Hospital Universitario de La Princesa, en Madrid. (FOTO: Luis Camacho).
Lydia López Manzanares, Eduardo GarcÃa Navarrete, José Antonio Fernández Alen, José Vivancos Mora, Cristina V. Torres DÃaz y Marta Navas GarcÃa, del Hospital Universitario de La Princesa, en Madrid. (FOTO: Luis Camacho).
 Equipo del Hospital de La Princesa que ha tratado el Tourette.
Equipo del Hospital de La Princesa que ha tratado el Tourette.
 La última convocatoria de oficinas de farmacia de Madrid es de 2018.
La última convocatoria de oficinas de farmacia de Madrid es de 2018.
 Luis González, presidente del COF de Madrid
Luis González, presidente del COF de Madrid
 La enfermera y divulgadora cientÃfica Esther Gómez ha sido reconocida con uno de los galardones Admirables 2021. Foto: Luis Camacho.
La enfermera y divulgadora cientÃfica Esther Gómez ha sido reconocida con uno de los galardones Admirables 2021. Foto: Luis Camacho.
 El Consejo Interterritorial de hoy no se ha pronunciado sobre el uso de mascarillas en el exterior. FOTO: Pool Moncloa/Borja Puig de la Bellacasa.
El Consejo Interterritorial de hoy no se ha pronunciado sobre el uso de mascarillas en el exterior. FOTO: Pool Moncloa/Borja Puig de la Bellacasa.
 La eurodiputada del PP Rosa Estarà s, en el Parlamento Europeo (Foto: PPE)
La eurodiputada del PP Rosa Estarà s, en el Parlamento Europeo (Foto: PPE)
 El mosquito 'Anopheles quadrimaculatus', un vector del virus del Nilo.
El mosquito 'Anopheles quadrimaculatus', un vector del virus del Nilo.
 En este segundo de asignación de plazas EIR 2021, se han adjudicado las 147 vacantes de Matronas que habÃa disponibles.
En este segundo de asignación de plazas EIR 2021, se han adjudicado las 147 vacantes de Matronas que habÃa disponibles.
 Oriol Grau, investigador del BBRC.
Oriol Grau, investigador del BBRC.
 Fachada del Hospital Rey Juan Carlos, uno de los centros de concesión administrativa de la Comunidad de Madrid (Foto: Hospital Rey Juan Carlos)
Fachada del Hospital Rey Juan Carlos, uno de los centros de concesión administrativa de la Comunidad de Madrid (Foto: Hospital Rey Juan Carlos)
 La investigación en covid-19 ha obligado a aparcar otros estudios en los hospitales españoles.
La investigación en covid-19 ha obligado a aparcar otros estudios en los hospitales españoles.
 Marta Tajes, Josep ComÃn y Carles DÃez López, de Bellvitge. Foto: Hospital de Bellvitge
Marta Tajes, Josep ComÃn y Carles DÃez López, de Bellvitge. Foto: Hospital de Bellvitge
 Carlos Rus, presidente de ASPE.
Carlos Rus, presidente de ASPE.
 Miembros de los equipos de MicrobiologÃa y Trasplante Hepático del Hospital Gregorio Marañón, de Madrid. FOTO: HGUGM.
Miembros de los equipos de MicrobiologÃa y Trasplante Hepático del Hospital Gregorio Marañón, de Madrid. FOTO: HGUGM.
 Células epiteliales humanas infectadas por E. coli.
Células epiteliales humanas infectadas por E. coli.
 Ana Barceló, consejera de Sanidad de la Comunidad Valenciana, en una comparecencia en las Cortes autonómicas.
Ana Barceló, consejera de Sanidad de la Comunidad Valenciana, en una comparecencia en las Cortes autonómicas.
 Quiz SEFAC
Quiz SEFAC
 Miembros de la Plataforma de Médicos Eventuales ante la fachada del Palacio de AljaferÃa, sede de las Cortes de Aragón (FOTO: Agencia Maaszoom).
Miembros de la Plataforma de Médicos Eventuales ante la fachada del Palacio de AljaferÃa, sede de las Cortes de Aragón (FOTO: Agencia Maaszoom).
 En 'consumer health', Andreu y RodrÃguez recomiendan a las farmacias apostar por una estrategia omnicanal.
En 'consumer health', Andreu y RodrÃguez recomiendan a las farmacias apostar por una estrategia omnicanal.
 Las principales sociedades cientÃficas de EnfermerÃa están en contra de la consulta pública sobre el Real Decreto por el que se establece la titulación de ‘Técnico Superior en Gestión de servicios en centros gerontológicos’ y piden su retirada. FOTO: Ariadna Creus y Ãngel GarcÃa (Banc Imatges Infermeres).
Las principales sociedades cientÃficas de EnfermerÃa están en contra de la consulta pública sobre el Real Decreto por el que se establece la titulación de ‘Técnico Superior en Gestión de servicios en centros gerontológicos’ y piden su retirada. FOTO: Ariadna Creus y Ãngel GarcÃa (Banc Imatges Infermeres).
 El lÃder de Vox, Santiago Abascal, y destacados dirigentes del partido atendieron a los medidos a la entrada del Tribunal Constitucional donde esta mañana han presentado su recurso a la ley de la eutanasia.
El lÃder de Vox, Santiago Abascal, y destacados dirigentes del partido atendieron a los medidos a la entrada del Tribunal Constitucional donde esta mañana han presentado su recurso a la ley de la eutanasia.
 Lourdes Méndez Monasterio, diputada de Vox.
Lourdes Méndez Monasterio, diputada de Vox.
 Placa de Petri que contiene E. coli.
Placa de Petri que contiene E. coli.
 La cirugÃa bariátrica permite tratar con éxito casos de obesidad mórbida.
La cirugÃa bariátrica permite tratar con éxito casos de obesidad mórbida.
 El investigador del CiMUS, José Castro TubÃo. FOTO: Santi Alvite.
El investigador del CiMUS, José Castro TubÃo. FOTO: Santi Alvite.
 la Comisión de Salud Pública del Ministerio de Sanidad ha incluido novedades este martes en la Estrategia de Vacunación.
la Comisión de Salud Pública del Ministerio de Sanidad ha incluido novedades este martes en la Estrategia de Vacunación.
 La incidencia acumulada mantiene la lenta evolución descendente que inició hace unas semanas.
La incidencia acumulada mantiene la lenta evolución descendente que inició hace unas semanas.
 ASHO cuenta con el 47% del mercado de codificación español.
ASHO cuenta con el 47% del mercado de codificación español.
 Un momento del procedimiento de trasplante de órganos.
Un momento del procedimiento de trasplante de órganos.
 Control de temperatura en residencia de la tercera edad.
Control de temperatura en residencia de la tercera edad.
 Carlos Sardinero.
Carlos Sardinero.
 Voluntarios del cuerpo local de bomberos en labores de desinfección en una residencia.(Foto: MSF)
Voluntarios del cuerpo local de bomberos en labores de desinfección en una residencia.(Foto: MSF)
 El Ministerio Público sostiene que con su actuación, las tres médicas provocaron "que no pudieran ser valorados por la unidad de geriatrÃa del hospital de referencia.
El Ministerio Público sostiene que con su actuación, las tres médicas provocaron "que no pudieran ser valorados por la unidad de geriatrÃa del hospital de referencia.
 Residencia asistida por un equipo de Mëdicos Sin Fronteras. Foto: MSF
Residencia asistida por un equipo de Médicos Sin Fronteras. Foto: MSF
Residencia asistida por un equipo de Mëdicos Sin Fronteras. Foto: MSF
Residencia asistida por un equipo de Médicos Sin Fronteras. Foto: MSF La Aemps recuerda que las notificaciones de acontecimientos adversos ocurridos tras la inmunización no se pueden considerar que son debidas a la vacuna hasta que no se confirme la relación causal.
La Aemps recuerda que las notificaciones de acontecimientos adversos ocurridos tras la inmunización no se pueden considerar que son debidas a la vacuna hasta que no se confirme la relación causal.
 Alberto López, número 1 del EIR 2021, esperando a la publicación de las listas de plazas EIR adjudicadas
Alberto López, número 1 del EIR 2021, esperando a la publicación de las listas de plazas EIR adjudicadas
 Almacén de Farmacia del Hospital de Ifema.
Almacén de Farmacia del Hospital de Ifema.
 Mar Guasp, Josep Dalmau, Lidia Sabater y Jon Landa, autores del estudio. Foto: ClÃnic/Idibaps
Mar Guasp, Josep Dalmau, Lidia Sabater y Jon Landa, autores del estudio. Foto: ClÃnic/Idibaps
 La candidata vacunal de Novavax, basada en la proteÃna 'S' recombinada junto a un adyuvante.
La candidata vacunal de Novavax, basada en la proteÃna 'S' recombinada junto a un adyuvante.
 Una unidad de SAMU, que sà incluye entre su personal a los facultativos (Foto: Generalitat Valenciana)
Una unidad de SAMU, que sà incluye entre su personal a los facultativos (Foto: Generalitat Valenciana)
 El Congreso de los Diputados acogió este lunes una sesión de la Comisión de Industria, Comercio y Turismo.
El Congreso de los Diputados acogió este lunes una sesión de la Comisión de Industria, Comercio y Turismo.
 Elena Castillo, diputada del PP en el Congreso de los Diputados.
Elena Castillo, diputada del PP en el Congreso de los Diputados.
 Aleix Prat, presidente del grupo Solti, y Josep Tabernero, director del VHIO, son los investigadores principales del ensayo 'Acropoli'.
Aleix Prat, presidente del grupo Solti, y Josep Tabernero, director del VHIO, son los investigadores principales del ensayo 'Acropoli'.
 Luis Liz Marzán, director cientÃfico del Centro de Investigación Cooperativa en Biomateriales-CIC biomaGUNE. (FOTO: LUIS CAMACHO).
Luis Liz Marzán, director cientÃfico del Centro de Investigación Cooperativa en Biomateriales-CIC biomaGUNE. (FOTO: LUIS CAMACHO).
 Carlos Simón Vallés, catedrático de PediatrÃa, Obstetricia y GinecologÃa de la Universidad de Valencia. (FOTO: LUIS CAMACHO).
Carlos Simón Vallés, catedrático de PediatrÃa, Obstetricia y GinecologÃa de la Universidad de Valencia. (FOTO: LUIS CAMACHO).
 Los fondos 'Next Generation Europe' llegarán durante tres años.
Los fondos 'Next Generation Europe' llegarán durante tres años.
 Julio Mayol es director médico del Hospital ClÃnico de Madrid. FOTO: Luis Camacho.
Julio Mayol es director médico del Hospital ClÃnico de Madrid. FOTO: Luis Camacho.
 Fernando Simón, director del CCAES. (FOTO: EFE/Kiko Huesca).
Fernando Simón, director del CCAES. (FOTO: EFE/Kiko Huesca).
 La artrosis de rodilla es la degeneración articular más frecuente.
La artrosis de rodilla es la degeneración articular más frecuente.
 Los manifestantes han tirado sus batas y pijamas frente al Ministerio de Sanidad, al que acusan de no dialogar con los sanitarios (Foto: José Luis Pindado)
Los manifestantes han tirado sus batas y pijamas frente al Ministerio de Sanidad, al que acusan de no dialogar con los sanitarios (Foto: José Luis Pindado)
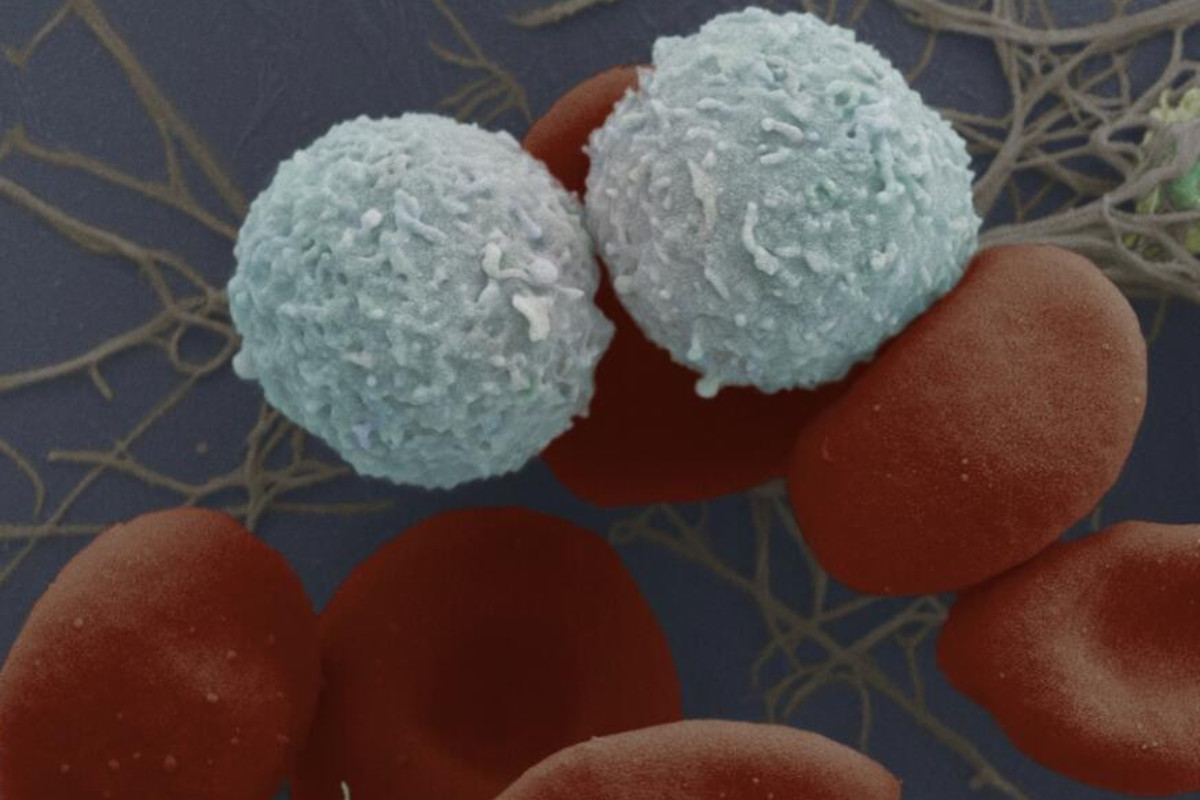 La leucemia linfoblástica aguda se caracteriza por la proliferación de blastos de estirpe linfoide.
La leucemia linfoblástica aguda se caracteriza por la proliferación de blastos de estirpe linfoide.
 Esta tarde de martes la Comisión de Salud Pública del Ministerio de Sanidad abordará la relajación del uso de la mascarilla en espacios exteriores y bajo ciertas condiciones.
Esta tarde de martes la Comisión de Salud Pública del Ministerio de Sanidad abordará la relajación del uso de la mascarilla en espacios exteriores y bajo ciertas condiciones.
 Aumenta el número de comunidades autónomas que de manera pública solicitan llevar al Consejo Interterritorial que se elimine la obligación de usar mascarilla en el exterior.
Aumenta el número de comunidades autónomas que de manera pública solicitan llevar al Consejo Interterritorial que se elimine la obligación de usar mascarilla en el exterior.
 La IA ya se encuentra a niveles de agosto de 2020.
Salud Pública estudia qué hacer con la mascarilla en el exterior este verano, con la posibilidad de rebajar su exigencia.
La IA ya se encuentra a niveles de agosto de 2020.
Salud Pública estudia qué hacer con la mascarilla en el exterior este verano, con la posibilidad de rebajar su exigencia. Para las personas con problemas de movilidad, la solución pasa por crear dispensaciones especiales que cuenten con la participación de la farmacia comunitaria (ILUSTRACIÓN: Gabriel Sanz)
Para las personas con problemas de movilidad, la solución pasa por crear dispensaciones especiales que cuenten con la participación de la farmacia comunitaria (ILUSTRACIÓN: Gabriel Sanz)
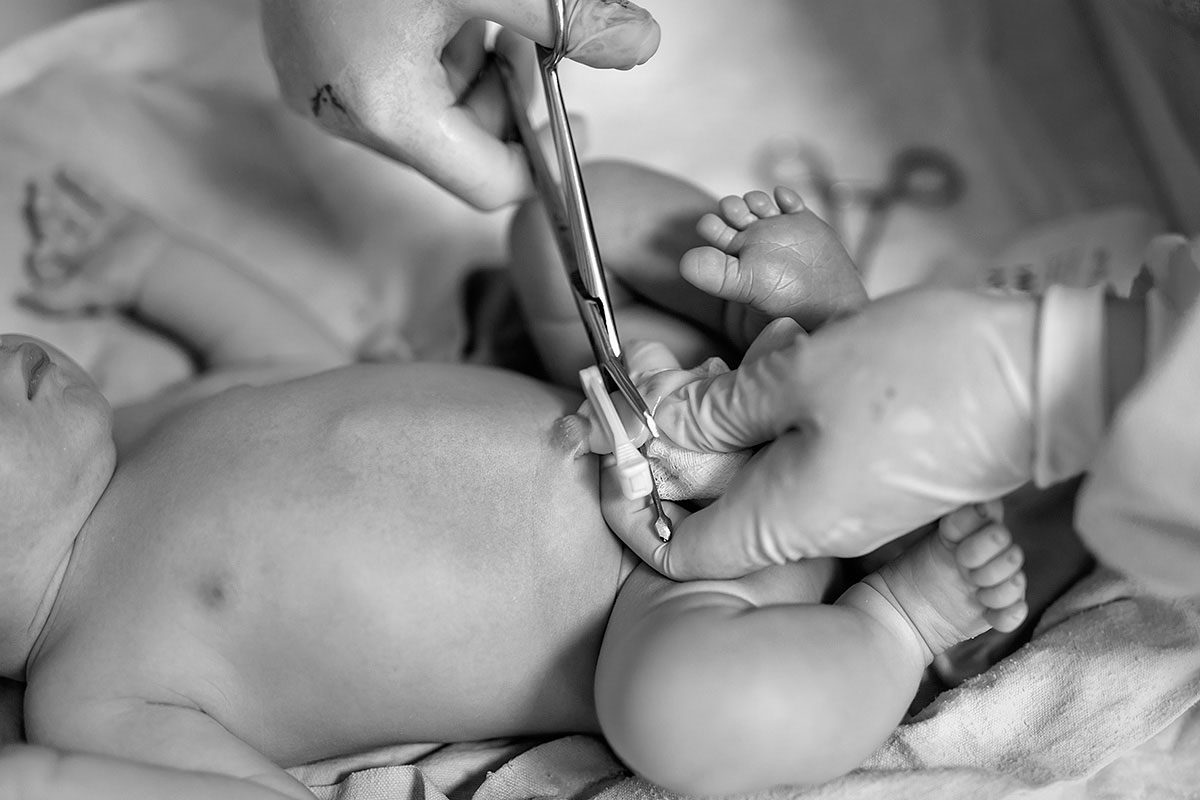 El TSJ de Extremadura defiende el derecho de que una madre pueda conversar el cordón umbilical de su hijo en bancos de SCU para uso propio.
El TSJ de Extremadura defiende el derecho de que una madre pueda conversar el cordón umbilical de su hijo en bancos de SCU para uso propio.


 Sanitarios a las puertas de un hospital
Sanitarios a las puertas de un hospital
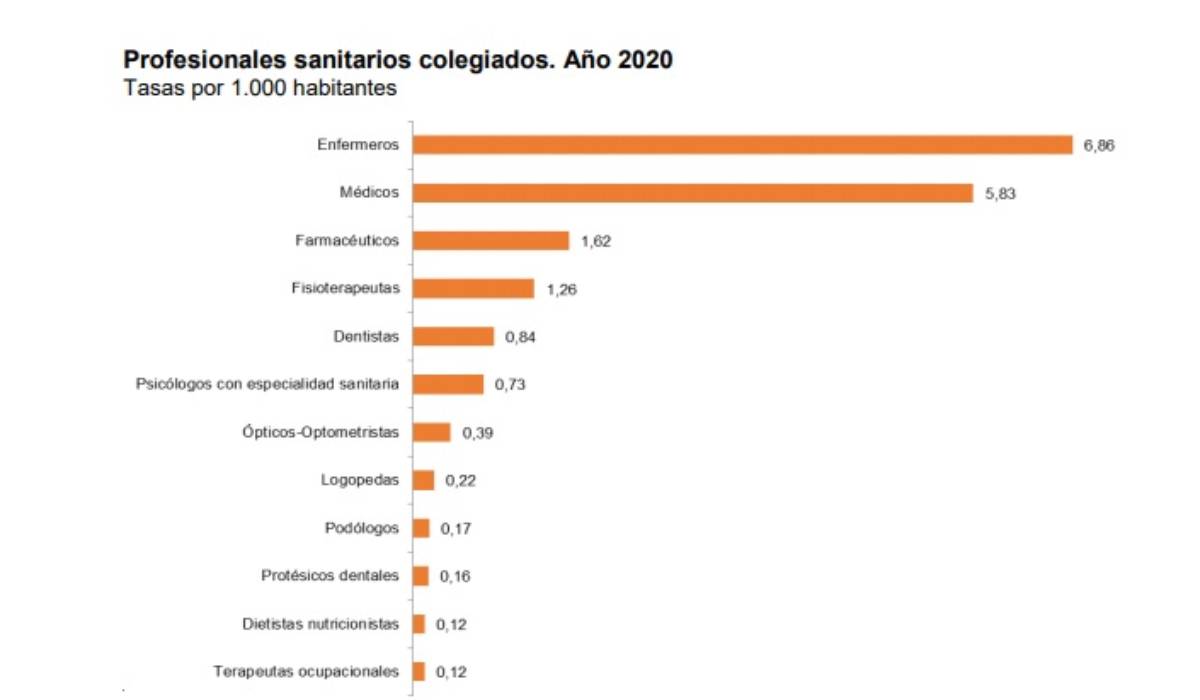 Sanitarios colegiados por 1.000 habitantes. /INE.
Sanitarios colegiados por 1.000 habitantes. /INE.
 El mieloma múltiple suele aparecer a edades avanzadas y progresar tras terapias. FOTO: DM.
El mieloma múltiple suele aparecer a edades avanzadas y progresar tras terapias. FOTO: DM.
 Cáncer de mama en imagen de mamografÃa.
Cáncer de mama en imagen de mamografÃa.
 Mario Fernández Ruiz, investigador 'Miguel Servet' de la Unidad de Enfermedades Infecciosas del Hospital 12 de Octubre, de Madrid.
Mario Fernández Ruiz, investigador 'Miguel Servet' de la Unidad de Enfermedades Infecciosas del Hospital 12 de Octubre, de Madrid.
 Miguel G. Corral, director de CF, dando la bienvenida a los asistentes a la Jornada de Gestión Práctica de la Oficina de Farmacia.
Miguel G. Corral, director de CF, dando la bienvenida a los asistentes a la Jornada de Gestión Práctica de la Oficina de Farmacia.
 La iniciativa multidisciplinar 'MilkCorona' está confirmando el papel protector de la leche materna frente a la infección.
La iniciativa multidisciplinar 'MilkCorona' está confirmando el papel protector de la leche materna frente a la infección.
 El efecto de las vacunas en la transmisión del coronavirus es una de las grandes incógnitas.
El efecto de las vacunas en la transmisión del coronavirus es una de las grandes incógnitas.
 Raúl Ortiz de Lejarazu, del Centro Nacional de Gripe de Valladolid.
Raúl Ortiz de Lejarazu, del Centro Nacional de Gripe de Valladolid. Roche personaliza la terapia con bomba de insulina
Roche personaliza la terapia con bomba de insulina

 Cursos de verano en lÃnea.
Cursos de verano en lÃnea.
 Profesionales de EnfermerÃa manejando fármacos correspondientes a los diferentes servicios y plantas del Hospital Vega Baja, en Alicante.
Profesionales de EnfermerÃa manejando fármacos correspondientes a los diferentes servicios y plantas del Hospital Vega Baja, en Alicante.
 : Uno de los SADM del Hospital Infanta Leonor, de Madrid, manejado por una profesional del Servicio de Farmacia.
: Uno de los SADM del Hospital Infanta Leonor, de Madrid, manejado por una profesional del Servicio de Farmacia.
 Cada vez acuden más a las farmacias un tipo de cliente omnicanal, que consume tanto en el mercado 'on line' como 'off line'.
Cada vez acuden más a las farmacias un tipo de cliente omnicanal, que consume tanto en el mercado 'on line' como 'off line'.
 Mariano Esteban, jefe del grupo de Poxvirus y Vacunas del CNB-CSIC.
Mariano Esteban, jefe del grupo de Poxvirus y Vacunas del CNB-CSIC.
 Aspecto de la manifestación de especialistas en formación del pasado 8 de junio a su paso por la sede del Congreso de los Diputados, en Madrid (FOTO: José Luis Pindado).
Aspecto de la manifestación de especialistas en formación del pasado 8 de junio a su paso por la sede del Congreso de los Diputados, en Madrid (FOTO: José Luis Pindado).
 El estrés puede influir en el sistema inmune. (ILUSTRACIÓN: Gabriel Sanz)
El estrés puede influir en el sistema inmune. (ILUSTRACIÓN: Gabriel Sanz)
 La Agencia Europea dice que la vacuna de AstraZeneca sigue siendo segura "para todos", pero aconseja evitar su uso entre los mayores de 60 años (FOTO: Luis Camacho).
La Agencia Europea dice que la vacuna de AstraZeneca sigue siendo segura "para todos", pero aconseja evitar su uso entre los mayores de 60 años (FOTO: Luis Camacho).
 Como Israel, EEUU ha detectado casos de inflamación cardÃaca en un bajo porcentaje de jóvenes tras inyectarles la segunda dosis de vacunas de ARNm.
Como Israel, EEUU ha detectado casos de inflamación cardÃaca en un bajo porcentaje de jóvenes tras inyectarles la segunda dosis de vacunas de ARNm.
 Yolanda Lejardi (segunda por la izquierda) conversa con un grupo de personas en un centro de vacunación masiva. Foto: ICS
Yolanda Lejardi (segunda por la izquierda) conversa con un grupo de personas en un centro de vacunación masiva. Foto: ICS
 Ana MarÃa Ruiz, Enfermera del Summa 112, promotora de la biblioteca de pacientes de Ifema y autora de "Libros que salvan vidas" (FOTO: Mauricio Skrycky).
Ana MarÃa Ruiz, Enfermera del Summa 112, promotora de la biblioteca de pacientes de Ifema y autora de "Libros que salvan vidas" (FOTO: Mauricio Skrycky).
 Ana MarÃa posa junto al carrito que fue el embrión de la biblioteca de pacientes de Ifema.
Ana MarÃa posa junto al carrito que fue el embrión de la biblioteca de pacientes de Ifema.
 Ana MarÃa muestra la tarjeta con el nombre de la cinta ganadora al Premio de la Mejor PelÃcula, en la última Gala de los Goya (FOTO: Academia de Cine).
Ana MarÃa muestra la tarjeta con el nombre de la cinta ganadora al Premio de la Mejor PelÃcula, en la última Gala de los Goya (FOTO: Academia de Cine).
 La ciberseguridad debe impregnar los sistemas sanitarios.
La ciberseguridad debe impregnar los sistemas sanitarios.
 Antonio Ramos, CEO y Socio Fundador de LEET Security.
Antonio Ramos, CEO y Socio Fundador de LEET Security.
 Montaje de OCT que muestra la sección transversal de un ojo humano.
Montaje de OCT que muestra la sección transversal de un ojo humano.
 Jaime Acosta acaba de convertirse en el único español y en el único no británico que forma parte del Comité Asesor de Expertos en Farmacia Digital de la Real Sociedad Farmacéutica (RPS según sus siglas en ingles).
Jaime Acosta acaba de convertirse en el único español y en el único no británico que forma parte del Comité Asesor de Expertos en Farmacia Digital de la Real Sociedad Farmacéutica (RPS según sus siglas en ingles).
 La principal innovación en medicamentos durante 2020 se ha centrado en el área de OncohematologÃa.
La principal innovación en medicamentos durante 2020 se ha centrado en el área de OncohematologÃa.
 Las largas jornadas de trabajo como las que implican las guardias tienen efectos nocivos para la salud
Las largas jornadas de trabajo como las que implican las guardias tienen efectos nocivos para la salud
 El protocolo recoge que la comunicación con el paciente con discapacidad visual que acude a la farmacia debe ser directa (hablando con él y no con el acompañante), natural y sin elevar la voz.
El protocolo recoge que la comunicación con el paciente con discapacidad visual que acude a la farmacia debe ser directa (hablando con él y no con el acompañante), natural y sin elevar la voz.
 Parte de los miembros de la candidatura ganadora en las elecciones al Pleno posa hoy ante la sede del CGE tras conocer el resultado (FOTO: CGE).
Parte de los miembros de la candidatura ganadora en las elecciones al Pleno posa hoy ante la sede del CGE tras conocer el resultado (FOTO: CGE).
 Francisco Marco, Fabián TarÃn y Paula Piñero, principales autores del trabajo.
Francisco Marco, Fabián TarÃn y Paula Piñero, principales autores del trabajo.
 La pandemia ha supuesto un cambio importante en la atención al paciente crónico. (ILUSTRACIÓN: Gabriel Sanz)
La pandemia ha supuesto un cambio importante en la atención al paciente crónico. (ILUSTRACIÓN: Gabriel Sanz)
 Puerta de un centro de salud de Madrid el dÃa que arrancaba la huelga indefinida convocada por Amyts en primaria, el pasado marzo (FOTO: Amyts).
Puerta de un centro de salud de Madrid el dÃa que arrancaba la huelga indefinida convocada por Amyts en primaria, el pasado marzo (FOTO: Amyts).
 El metilmercurio consumido durante el embarazo y lactancia puede atravesar la placenta o excretarse a través de la lecha materna.
El metilmercurio consumido durante el embarazo y lactancia puede atravesar la placenta o excretarse a través de la lecha materna.
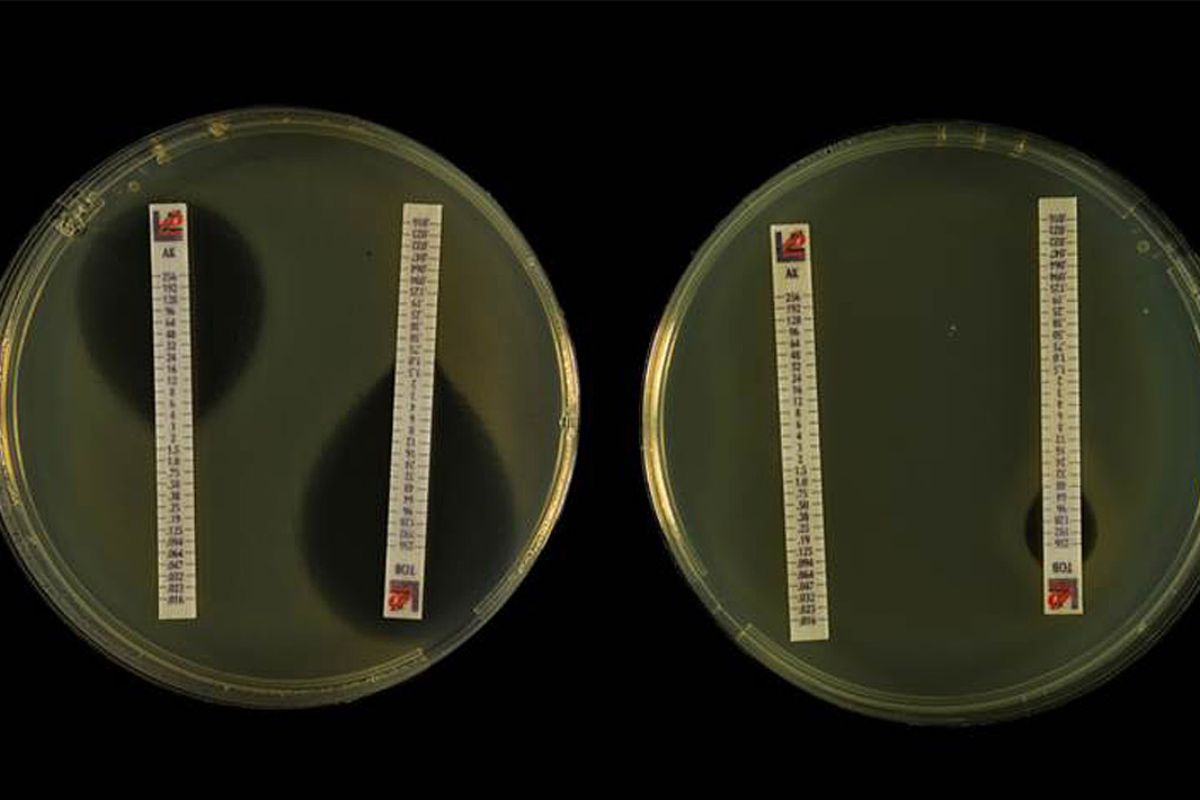 El crecimiento de las resistencias bacterianas crece en España. FOTO: DM.
El crecimiento de las resistencias bacterianas crece en España. FOTO: DM.
 Sergio Teixera, CEO de Biogen en España.
Sergio Teixera, CEO de Biogen en España.
 Los expertos destacan el valor asistencial de la farmacia.
Los expertos destacan el valor asistencial de la farmacia.
 La fundadora de Hifas da Terra, Catalina Fernández de Ana Portela.
La fundadora de Hifas da Terra, Catalina Fernández de Ana Portela.
 Catalina Fernández de Ana Portela ha heredado la pasión por los hongos de su padre, un cientÃfico e investigador experto también en fitopatologÃa, y la ha transformado en su forma de vida y en su proyecto empresarial.
Catalina Fernández de Ana Portela ha heredado la pasión por los hongos de su padre, un cientÃfico e investigador experto también en fitopatologÃa, y la ha transformado en su forma de vida y en su proyecto empresarial.
 Hifas da Terra tiene distintas técnicas de extractados de activos de los hongos, como la acuosa y la hidroalcohólica, y otras más novedosas, como la de ultrasonidos.
Hifas da Terra tiene distintas técnicas de extractados de activos de los hongos, como la acuosa y la hidroalcohólica, y otras más novedosas, como la de ultrasonidos.
 La empresa lleva a cabo ensayos 'in vitro', con modelos celulares y murinos" y, actualmente, está en fase de reclutamiento para su primer ensayo clÃnico en cáncer colorrectal.
La empresa lleva a cabo ensayos 'in vitro', con modelos celulares y murinos" y, actualmente, está en fase de reclutamiento para su primer ensayo clÃnico en cáncer colorrectal.
 MarÃa Jesús Lamas, directora de la Agencia Española de Medicamentos y Productos Sanitarios.
MarÃa Jesús Lamas, directora de la Agencia Española de Medicamentos y Productos Sanitarios.
 Colas de espera para la vacunación en el Hospital Enfermera Zendal, en Madrid. (FOTO: EFE/Zipi)
Colas de espera para la vacunación en el Hospital Enfermera Zendal, en Madrid. (FOTO: EFE/Zipi)
 Andreu MartÃnez, número 1 de la convocatoria FIR 2021, esperando a que comenzaran los actos de adjudicación de plazas
Andreu MartÃnez, número 1 de la convocatoria FIR 2021, esperando a que comenzaran los actos de adjudicación de plazas
 Farmazul es una agrupación que integra a farmacias concienciadas de la necesidad de adoptar una estrategia común y centradas en el consumidor.
Farmazul es una agrupación que integra a farmacias concienciadas de la necesidad de adoptar una estrategia común y centradas en el consumidor.
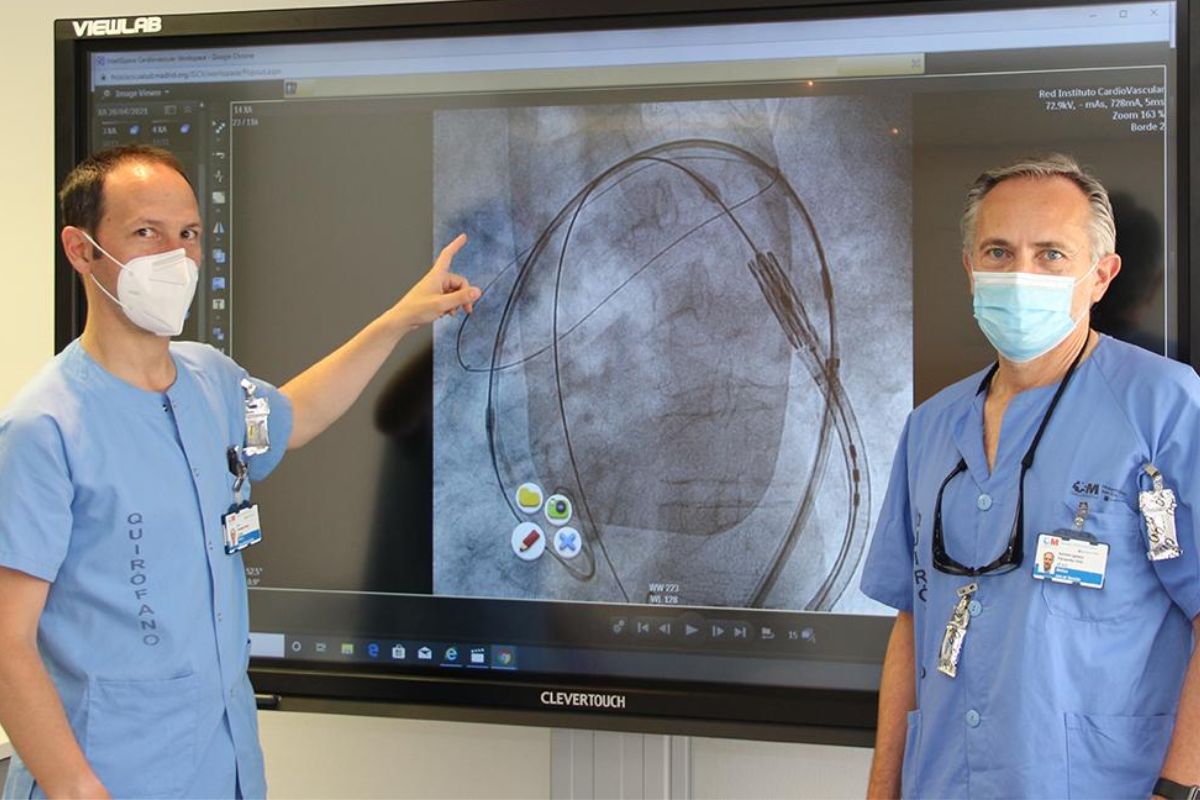 Luis Nombela-Franco, a la izquierda, y Antonio Fernández Ortiz, cardiólogos del Hospital ClÃnico de Madrid, explican la utilidad del nuevo dispositivo. FOTO: HUCS.
Luis Nombela-Franco, a la izquierda, y Antonio Fernández Ortiz, cardiólogos del Hospital ClÃnico de Madrid, explican la utilidad del nuevo dispositivo. FOTO: HUCS.
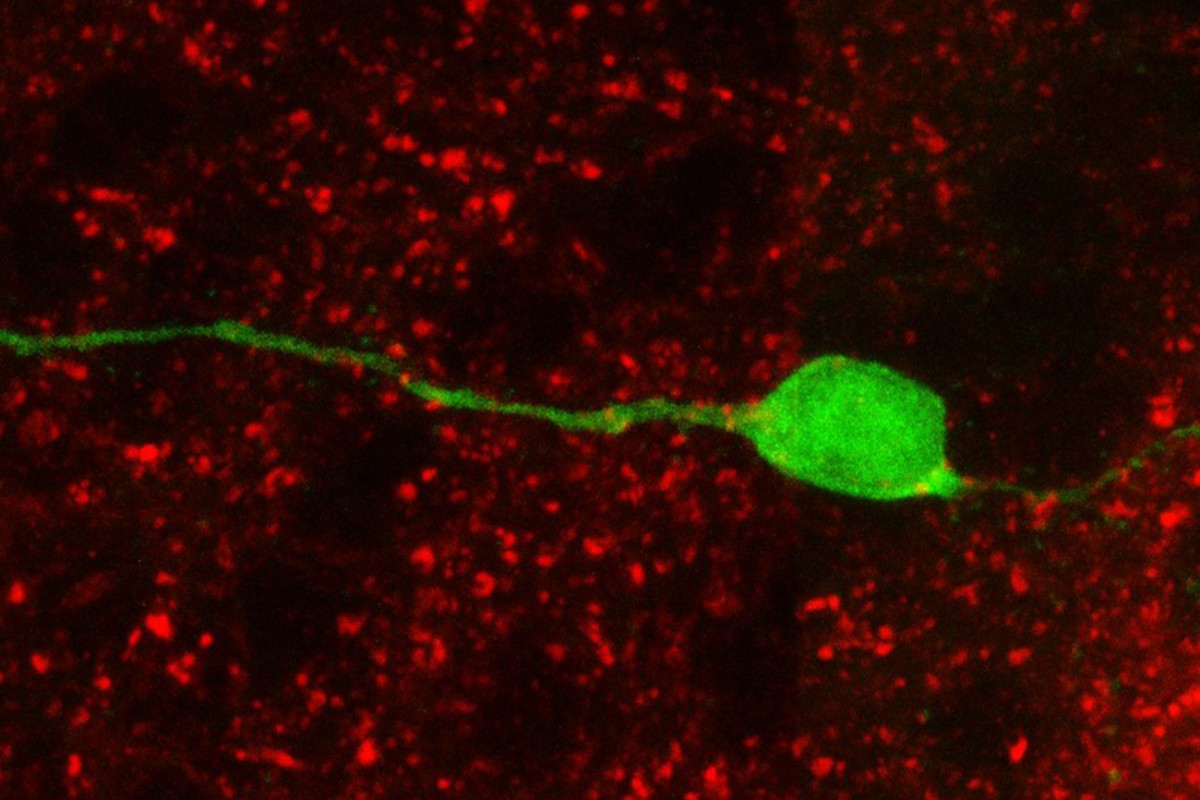 Neurona (verde) generada a partir de células madre neurales del bulbo olfatorio, con botones sinápticos formados por la proteÃna sinapsina (en rojo), lo que indica contactos sinápticos (C. Vicario et al.).
Neurona (verde) generada a partir de células madre neurales del bulbo olfatorio, con botones sinápticos formados por la proteÃna sinapsina (en rojo), lo que indica contactos sinápticos (C. Vicario et al.).
 El objetivo de la terapia celular y génica, como las que están ensayando las afiliadas de Bayer, es actuar directamente sobre la enfermedad y su origen, e ir más allá del tratamiento de los sÃntomas.
El objetivo de la terapia celular y génica, como las que están ensayando las afiliadas de Bayer, es actuar directamente sobre la enfermedad y su origen, e ir más allá del tratamiento de los sÃntomas.
 La ley contempla la posibilidad de que sean los colegios de médicos quienes asuman el papel de desarrollar los necesarios registros de objetores a la eutanasia, una opción que los colegios también ven con factible.
La ley contempla la posibilidad de que sean los colegios de médicos quienes asuman el papel de desarrollar los necesarios registros de objetores a la eutanasia, una opción que los colegios también ven con factible.
 Más de mil médicos han respondido a la encuesta de la Camfic.
Más de mil médicos han respondido a la encuesta de la Camfic.