MicrobiologÃa y Enfermedades Infecciosas
raquelserrano
Jue, 28/09/2023 - 08:00
Comienzan a tomar forma hipÃģtesis sobre su origen y actividad
Numerosos laboratorios de todo el mundo investigan el origen y los efectos de la covid persistente. Foto: AGEFOTOSTOCK.
El inicio de la pandemia por el SARS-CoV-2 en 2020 marcÃģ un antes y un despuÃĐs en la salud de la poblaciÃģn mundial. A los miles de personas que fallecieron a causa de su enfermedad viral derivada, la covid-19, se unieron los millones de infectados por este nuevo virus que a dÃa de hoy se mueve entre nosotros -se han cifrado cerca de 800 millones infecciones en estos momentos en todo el mundo-, asà como los miles de personas en los que los sÃntomas de la enfermedad no remitÃan una vez pasada la fase aguda infecciosa; lo que actualmente se denomina covid persistente, covid crÃģnico o long covid.
La ciencia considera que la covid persistente es una nueva enfermedad o sÃndrome cuya afectaciÃģn se cifra entre el 10% y el 20%, segÚn series, entre las personas que han sufrido una infecciÃģn por SARS-CoV-2.Â
La Red EspaÃąola de InvestigaciÃģn en Covid Persistente (REiCOP) estÃĄ a punto de poner en marcha un registro de afectados, por lo que, de momento, los datos que se manejan son estimaciones, reconoce Pilar RodrÃguez Ledo, presidenta de la REiCOP y de la Sociedad EspaÃąola de MÃĐdicos Generales y de Familia (SEMG).
"La covid persistente sigue estando ahÃ, continÚa el riesgo de que aparezca tras una infecciÃģn, pero probablemente el porcentaje de casos sea algo menor que antes: del 10% de pacientes infectados que manejÃĄbamos al inicio de la pandemia, en estos momentos estimamos que se ha reducido un par de puntos al menos".
A esa reducciÃģn han contribuido la apariciÃģn de nuevas variantes, una expansiÃģn de la inmunidad y el hecho de que el contagio y la enfermedad aguda son ahora menos intensos que antes. "No obstante, aÚn hay pacientes que se contagiaron en 2020 afectados por la covid persistente. Sobre todo, entre aquellos que tuvieron unas clÃnicas muy intensas en las primeras horas de la pandemia", segÚn RodrÃguez Ledo.Â
Variaciones en todas sus vertientesÂ
Puede aparecer a cualquier edad, con sÃntomas que persisten semanas o meses despuÃĐs de la infecciÃģn inicial, aparecen de nuevo o reaparecen, con sÃntomas mÚltiples y, en algunos casos, intensos, capaces de incapacitar el devenir normal de los afectados. La OMS ha identificado y reconocido mÃĄs de 200 sÃntomas que requieren abordaje y tratamiento multidisciplinar.
Tal es la magnitud de esta nueva realidad que los expertos de la REiCOP insisten en la necesidad de seguir sumando esfuerzos para conocer la verdadera extensiÃģn y sus efectos a largo plazo que siguen generando numerosas investigaciones y revisiones cientÃficas, como la reciÃĐn publicada en BMJ Evidence-Based Medicine.
Asà pues, 'las secuelas' de la covid-19 siguen siendo un reto para la investigaciÃģn y una realidad sanitaria emergente, cuyo manejo, afortunadamente, ha mejorado con la experiencia clÃnica en estos tres aÃąos, pero de las que aÚn queda mucho por aprender.
Juan Ignacio Ramos Clemente, jefe del Servicio de Medicina Interna del Hospital Infanta Elena de Huelva -centro pionero en la puesta en marcha en 2020 de una Unidad de covid persistente dependiente del citado servicio, pero con un funcionamiento multidisciplinar-, explica que en estos momentos hay un cierto consenso sobre quÃĐ puede considerarse como covid persistente: cuando se presentan sÃntomas durante un periodo superior a tres meses despuÃĐs de haber sufrido la infecciÃģn por covid-19 y siendo esos sÃntomas de nueva apariciÃģn, es decir, que no se corresponden con el agravamiento de una patologÃa previa.
Actualmente se considera covid persistente cuando los sÃntomas se mantienen durante tres meses y son de nueva apariciÃģnÂ
"Uno de los problemas mÃĄs importantes es que, en estos momentos, hay mÃĄs de 200 sÃntomas identificados. Por esta razÃģn, en nuestra unidad los agrupamos por aparatos o por esferas; asà tenemos pacientes de perfil neurolÃģgico, cardiovascular, respiratorio, osteomuscular. Pero, en algunos casos, se presentan sÃntomas de esferas diferentes, ya que pueden tener fatiga y cansancio muscular, asà como alteraciones de concentraciÃģn y memoria".
Aunque puede afectar a personas de cualquier edad, sà es cierto que existe un perfil de paciente con mÃĄs riesgo de sufrirla, pero que es independiente de la gravedad o levedad de la infecciÃģn por covid-19; el grado de afectaciÃģn no condiciona su apariciÃģn. "Sà sabemos que las mujeres tienen mÃĄs posibilidades de desarrollarla, asà como personas obesas o aquellas que previamente a la infecciÃģn hayan presentado algÚn tipo de enfermedad autoinmune", seÃąala Ramos.Â

Los sÃntomas de la covid persistente son variados y pueden ser de leves a graves. Foto: AGEFOTOSTOCK.
En cuanto a la sintomatologÃa clÃnica, las relacionadas con la esfera osteomuscular -cansancio, debilidad y dolor-, y con la neurolÃģgica -dificultad para la concentraciÃģn, la lentitud en el pensamiento y las alteraciones en gusto y olfato-, son las mÃĄs frecuentes, aunque afortunadamente no las mÃĄs graves. La gravedad suele asociarse a cuadros clÃnicos donde lo que predomina es la dificultad para respirar o trombosis recurrentes por covid persistente, entre otras alteraciones.
En estos momentos, la comunidad cientÃfica trata de desvelar los mecanismos Ãntimos del origen y desarrollo de este sÃndrome. MarÃa del Mar TomÃĄs, portavoz de la Sociedad EspaÃąola de Enfermedades Infecciosas y MicrobiologÃa ClÃnica (Seimc), y miembro del Servicio de MicrobiologÃa del Hospital Universitario A CoruÃąa, explica que los estudios apuntan a un origen multifactorial del trastorno, pero hay dos hipÃģtesis cada vez mÃĄs fuertes sobre su causa.Â
Descifrando el origenÂ
"Por un lado, la infecciÃģn genera reservorios virales, no se elimina del todo al virus, puede que por un dÃĐficit inmunitario de la persona infectada. Los anÃĄlisis sitÚan a los reservorios del virus sobre todo a nivel endotelial. El endotelio es una de las dianas de las variantes de SARS-CoV-2 anteriores a Ãģmicron. No obstante, hacen falta mÃĄs anÃĄlisis en ese sentido".Â
Una segunda hipÃģtesis es que la covid persistente se produce por una reacciÃģn autoinmune: el organismo reacciona a la infecciÃģn produciendo autoanticuerpos. "La covid-19 se ha asociado con el incremento de enfermedades autoinmunes, sin ir mÃĄs lejos, la diabetes. AdemÃĄs, los pacientes que se seÃąalan con mayor probabilidad de covid persistente en los estudios han tenido alteraciones autoinmunes, como artritis reumatoide. TambiÃĐn se ha asociado mÃĄs a mujeres, pues no hay que olvidar que el sistema hormonal participa en la regulaciÃģn inmunolÃģgica", indica TomÃĄs.Â
De hecho, un estudio que se acaba de publicar en Nature aporta nuevos datos que refuerzan la idea de que las personas con covid persistente tienen diferencias hormonales e inmunitarias.
La activaciÃģn de los linfocitos T se mantiene, de entre 18 a 24 meses, aunque la infecciÃģn no estÃĐ ya activaÂ
SegÚn Ramos, la enfermedad estÃĄ muy relacionada con la activaciÃģn del sistema inmunitario, mÃĄs allÃĄ de la propia presencia de la covid-19. "Este patrÃģn ya se habÃa observado en otros virus, como es el caso del de la mononucleosis infecciosa: aparece, se padece la infecciÃģn y, posteriormente, se presenta un periodo sintomÃĄtico mÃĄs allÃĄ de la presencia del virus en sangre".
La diferencia con la covid persistente es, a su juicio, la persistencia, la durabilidad de todo el cuadro posterior. A pesar de que existen distintas teorÃas al respecto, "se sabe que la activaciÃģn de los linfocitos T despuÃĐs de la infecciÃģn se mantiene durante mucho mÃĄs tiempo, incluso aunque el paciente ya no tenga infecciÃģn activa. Mucho tiempo es muchÃsimo mÃĄs de lo que se habÃa observado en cualquier tipo de infecciÃģn vÃrica: periodos que se sitÚan entre un mÃnimo de 18-24 meses", indica el internista.Â
Curiosamente, prosigue este profesional, esta activaciÃģn podrÃa explicar tambiÃĐn la causa de que la persistencia de sÃntomas sea mÃĄs probable  -de hecho parece ser el grupo mÃĄs numeroso-, en personas con edades comprendidas entre los 35 y los 55 aÃąos.Â
"Personas que, teÃģricamente, tienen un sistema inmunolÃģgico mÃĄs sano, pero en los que el riesgo de desarrollar el sÃndrome es mayor, precisamente por la relaciÃģn entre el sistema inmune y la presencia de sÃntomas mantenidos. Claro estÃĄ que esta situaciÃģn es matizable, ya que personas con enfermedades de tipo inmunitario tambiÃĐn podrÃan tener mÃĄs riesgo. Pero, desde luego, su origen no se relaciona con la 'debilidad' o con ser anciano".
Sobre su etiologÃa, RodrÃguez Ledo, indica que cada vez estÃĄ mÃĄs en auge la idea de que el origen de la enfermedad sea posiblemente una combinaciÃģn de alteraciones inmunitarias y la presencia de virus acantonado en reservorios; "sobre esta Última estÃĄ creciendo la bibliografÃa que lo testifica. Seguramente, estamos ante un complejo etiolÃģgico donde cada factor aporta una predisposiciÃģn determinada y una evoluciÃģn, y es el conjunto de todos los factores lo que acaba determinando el perfil patolÃģgico del paciente, por eso hay tanta variabilidad en la covid persistente".Â
ÂŋPor quÃĐ unos sà y otros no?Â
Al igual que ocurre con la infecciÃģn por SARS-CoV-2, donde hay personas que desarrollan cuadros graves frente a otros que son leves o asintomÃĄticos, en la covid persistente un aspecto esencial serÃa concretar por quÃĐ en unas personas se mantienen los sÃntomas y en otras no, hecho del que, segÚn el internista del Infanta Elena de Huelva, se aprende dÃa a dÃa: "una de las frases que les digo a los pacientes cuando llegan a consulta es: aquà estamos aprendiendo los dos".
Este profesional subraya que, en este sentido, hay muchas teorÃas que se postulan como posibilidad de origen del proceso y se empiezan a conocer ciertos aspectos 'llamativos'. Por ejemplo, los datos derivados de un gran estudio han encontrado que los pacientes diabÃĐticos que tomaban metformina desarrollaban menos covid persistente frente a los que no la tomaban. De la misma forma, un trabajo publicado este aÃąo en The Lancet seÃąalaba que existÃan mÃĄs linfocitos T activados en el pulmÃģn, en el cerebro y en el intestino de las personas que tenÃan covid persistente.
Los linfocitos T parecen estar mÃĄs activados, y durante mÃĄs tiempo, en afectados por esta enfermedad. Foto: AGEFOTOSTOCK.
"A partir de estos datos, la pregunta es si detrÃĄs de estos hechos se encuentra o no el origen de la enfermedad. Actualmente existen muchas lÃneas de hipÃģtesis abiertas, pero sin certezas concretas". Por supuesto, no se puede olvidar el patrÃģn genÃĐtico personal, teniendo en cuenta que el virus se comporta de manera diferente en cada individuo, aun siendo el mismo virus", destaca Ramos Clemente. Â
A lo largo de estos tres aÃąos de pandemia, en la que se han sucedido diferentes variantes vÃricas -actualmente mÃĄs infectivas pero de menor agresividad-, los profesionales no han podido confirmar que estas Últimas se relacionen con menos casos de covid persistente o que los sÃntomas sean diferentes.
El escenario sintomÃĄtico no es tan amplio y florido; ha variado bastante con la vacunaciÃģnÂ
Los sÃntomas, segÚn Ramos, "son demasiado heterogÃĐneos. Pero, actualmente, sà estamos observando que, aunque se produce el mismo nÚmero de casos, el complejo sintomÃĄtico no es tan amplio como el que se veÃa en las primeras oleadas. El escenario cambiÃģ bastante con la vacunaciÃģn. Antes de las vacunas, los perfiles clÃnicos eran muy floridos: muchos sÃntomas y de esferas diferentes. Ahora, los sÃntomas aparecen en menos esferas a la vez, pero siguen siendo los mismos. La percepciÃģn es que los pacientes tienen los mismos sÃntomas, pero mÃĄs agrupados".
La amenaza de las reinfeccionesÂ
En lo que se refiere a las reinfecciones por covid-19, el equipo del Infanta Elena de Huelva ha observado que cuando un paciente padece covid persistente y se vuelve a contagiar, "su covid persistente empeora", segÚn los datos del seguimiento que se lleva a cabo en su unidad, lo que pone de manifiesto que las reinfecciones agravarÃan los sÃntomas.
En esta misma lÃnea, TomÃĄs seÃąala que hay investigadores que indican que con las reinfecciones se eleva el riesgo de long covid; pero "es complicado no infectarnos dada la cantidad de subvariantes que hay circulando ahora. Resulta muy difÃcil no tener contacto con alguna de ellas".
A su juicio, "la Única forma de reducir el riesgo es a travÃĐs de la vacuna actualizada", tal y como sugieren los datos de un estudio publicado en el archivo de preprint Medrxiv, realizado por investigadores australianos sobre 22.744 personas con covid-19, que ha analizado la presencia de covid persistente entre la poblaciÃģn vacunada.
Un 18% de las personas que habÃan recibido 3 dosis de la vacuna -que no estaba adaptada a la variante Ãģmicron- desarrollaron covid persistente. "Nos falta saber quÃĐ habrÃa ocurrido si hubiesen recibido la vacuna adaptada a las subvariantes. Nadie puede garantizar con una seguridad del cien por cien que la vacuna te protege de la covid persistente, pero es lo Único preventivo mÃĄs seguro que hay en estos momentos".Â
Ante la descripciÃģn de este panorama, Ramos no duda en seÃąalar que nos encontramos ante una nueva enfermedad o nuevo sÃndrome. "Absolutamente. Este cuadro no se comporta como lo hacen otros virus. El mecanismo lo conocÃamos porque estaba presente en otros escenarios, pero ni con la dimensiÃģn ni la intensidad que lo hace en el covid-19. Es un cuadro totalmente diferente".
Los tratamientos que se llevan a cabo en su manejo son individualizados, ajustÃĄndose al perfil clÃnico de cada paciente. Para aliviar los sÃntomas -fatiga y deterioro cognitivo estÃĄn entre los mÃĄs habituales-, TomÃĄs seÃąala que se recurre a rehabilitaciÃģn neurocognitiva y respiratoria, terapia ocupacional, logopedia y ejercicio fÃsico.
"TambiÃĐn se estudia la utilidad de la estimulaciÃģn elÃĐctrica para mejorar los sÃntomas, pero sin dirigirse al origen de la enfermedad".Â
Inteligencia artificial para ayudar a los pacientes con covid persistente... y a sus mÃĐdicos, Ante las incÃģgnitas de la covid persistente, Ya estÃĄn aquà las nuevas vacunas frente a Ãģmicron para hacer de escudo a la covid-19
En elïŋ―escenario terapÃĐutico,ïŋ―la experiencia indica que "hay que abordar la terapia con cierta perspectiva. Un sÃndrome tan complejo, con afectaciÃģn en
AfectarÃa hasta al 20% de la poblaciÃģn, con sÃntomas e intensidad variables. Un desafÃo para la investigaciÃģn de la que depende el desarrollo de terapias realmente efectivas.
Off
Raquel Serrano/Sonia Moreno. Madrid
NeumologÃa
Medicina FÃsica y RehabilitaciÃģn
Medicina Preventiva y Salud PÚblica
Medicina del Trabajo
CardiologÃa
NeurologÃa
OtorrinolaringologÃa
PsicologÃa
Trabajo Social
Off












 Tohid Didar, Sara Rahmani y Elena Verdu, investigadores de la de la Universidad McMaster. Foto: GEORGIA KIRKOS/UNIVERSIDAD McMASTER.
Tohid Didar, Sara Rahmani y Elena Verdu, investigadores de la de la Universidad McMaster. Foto: GEORGIA KIRKOS/UNIVERSIDAD McMASTER.
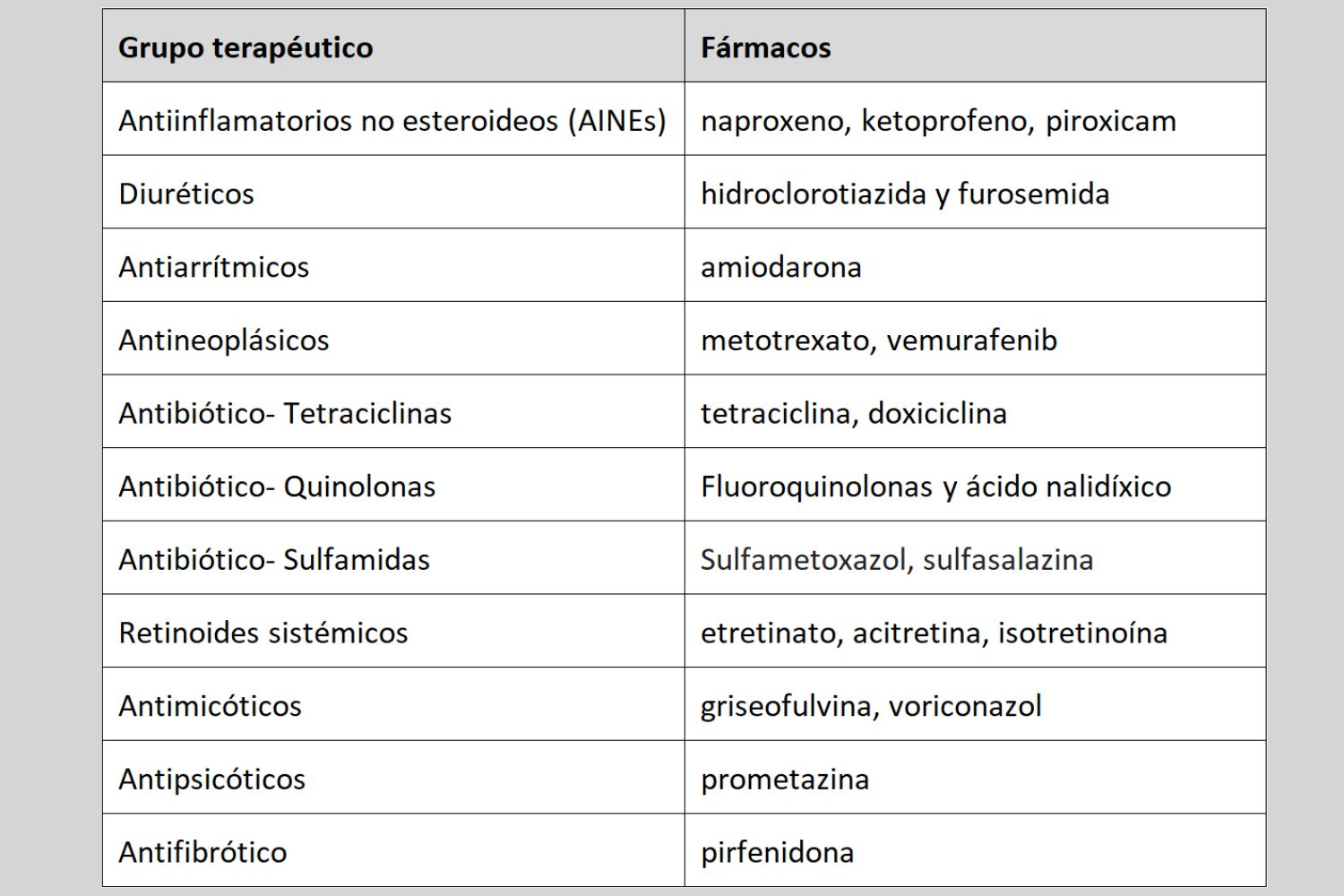 Principales grupos terapéuticos y sus fármacos que causan reacciones con el sol. Cuadro: VICTORIA VILLAGRASA.
Principales grupos terapéuticos y sus fármacos que causan reacciones con el sol. Cuadro: VICTORIA VILLAGRASA.

 José Antonio Sobrino, catedrático de la UV, y principal investigador del proyecto. Foto: UV.
José Antonio Sobrino, catedrático de la UV, y principal investigador del proyecto. Foto: UV.


 La investigadora Belén López Millán. Foto: INSTITUTO JOSEP CARRERAS.
La investigadora Belén López Millán. Foto: INSTITUTO JOSEP CARRERAS.




 Rosa Ortega Anta, catedrática de Nutrición de la Universidad Complutense (UCM) de Madrid. Foto: DM.
Rosa Ortega Anta, catedrática de Nutrición de la Universidad Complutense (UCM) de Madrid. Foto: DM.

 Pablo Ryan explica la necesidad de una asistencia equitativa. Foto: PR.
Pablo Ryan explica la necesidad de una asistencia equitativa. Foto: PR.



 Laureano Molins, Juan Carlos Trujillo, Luis Seijo, Margarita Majem y Santiago Ramón y Cajal en el encuentro de la Lung Ambition Alliance. Foto: DM.
Laureano Molins, Juan Carlos Trujillo, Luis Seijo, Margarita Majem y Santiago Ramón y Cajal en el encuentro de la Lung Ambition Alliance. Foto: DM.








 Luis Cabaņas, presidente de CODiNuCoVa e investigador principal del ENPIV. Foto: CODiNuCoVa.
Luis Cabaņas, presidente de CODiNuCoVa e investigador principal del ENPIV. Foto: CODiNuCoVa.



 José Manuel Cameselle, Susana Bravo, Mari Suárez Fariņa, Miguel Chenlo, Sihara Pérez Romero, Clara Álvarez y Narciso Blanco, profesionales que han realizado la investigación. Foto: CIMUS.
José Manuel Cameselle, Susana Bravo, Mari Suárez Fariņa, Miguel Chenlo, Sihara Pérez Romero, Clara Álvarez y Narciso Blanco, profesionales que han realizado la investigación. Foto: CIMUS.






 Carlos Bocos, a la izquierda de la imagen, con el equipo de NUTRIPRO de la Universidad San Pablo CEU. Foto: San Pablo CEU.
Carlos Bocos, a la izquierda de la imagen, con el equipo de NUTRIPRO de la Universidad San Pablo CEU. Foto: San Pablo CEU.


 La pérdida de masa muscular puede conllevar a sarcopenia, alteración que afecta a la población anciana. Foto: SHUTTERSTOCK.
La pérdida de masa muscular puede conllevar a sarcopenia, alteración que afecta a la población anciana. Foto: SHUTTERSTOCK.
 Nuevos datos analizan las posibilidades del origen de laboratorio del virus SARS-CoV-2. Foto: SHUTTERSTOCK.
Nuevos datos analizan las posibilidades del origen de laboratorio del virus SARS-CoV-2. Foto: SHUTTERSTOCK.
 La diálisis, una modalidad terapéutica para enfermedad renal avanzada. Foto: DM.
La diálisis, una modalidad terapéutica para enfermedad renal avanzada. Foto: DM.
 Patricia Muņoz y Patricia de Sequeros, ambas del Infanta Leonor de Madrid, han sido galardonadas por sus estudios en diálisis. Foto: HUIL.
Patricia Muņoz y Patricia de Sequeros, ambas del Infanta Leonor de Madrid, han sido galardonadas por sus estudios en diálisis. Foto: HUIL.
 Miles de personas se han manifestado en Santiago de Compostela por la sanidad pública. Foto: EFE. Xoan Rey.
Miles de personas se han manifestado en Santiago de Compostela por la sanidad pública. Foto: EFE. Xoan Rey.
 La investigación, herramienta clave para avanzar en el ámbito oncológico. Foto: SUTTERSTOCK.
La investigación, herramienta clave para avanzar en el ámbito oncológico. Foto: SUTTERSTOCK.
 Valencia garantizará el acceso a todos los recursos oncológicos. Foto: DM.
Valencia garantizará el acceso a todos los recursos oncológicos. Foto: DM.
 El presunto falso médico trabajó durante la pandemia en dos geriátricos de Barcelona.
El presunto falso médico trabajó durante la pandemia en dos geriátricos de Barcelona.
 Ignasi Catalá es director médico del Instituto Clavel, especializado en abordaje neuroquirúrgico. Foto: INSTITUTO CLAVEL.
Ignasi Catalá es director médico del Instituto Clavel, especializado en abordaje neuroquirúrgico. Foto: INSTITUTO CLAVEL.
 Ignasi Catalá explica los avances conseguidos y los retos futuros en su especialidad. Foto: INSTITUTO CLAVEL.
Ignasi Catalá explica los avances conseguidos y los retos futuros en su especialidad. Foto: INSTITUTO CLAVEL.
 Susana Carmona, miembro del equipo que ha realizado el análisis en gestantes. Foto: DM.
Susana Carmona, miembro del equipo que ha realizado el análisis en gestantes. Foto: DM.
 La preeclampsia aparece en entre el 2 y 5% de las gestaciones. Foto: DM.
La preeclampsia aparece en entre el 2 y 5% de las gestaciones. Foto: DM.
 La inteligencia artificial es una herramienta clave para conocer el pronóstico patológico. Foto: DM.
La inteligencia artificial es una herramienta clave para conocer el pronóstico patológico. Foto: DM.
 ŋCuál es el impacto de la ingesta dietética de sodio sobre la presión arterial en personas de mediana edad y de edad avanzada?
ŋCuál es el impacto de la ingesta dietética de sodio sobre la presión arterial en personas de mediana edad y de edad avanzada?
 Deepak Gupta, coinvestigador principal del estudio y profesor en la Universidad de Vanderbilt, Estados Unidos. Foto: UV.
Deepak Gupta, coinvestigador principal del estudio y profesor en la Universidad de Vanderbilt, Estados Unidos. Foto: UV.
 La muerte súbita se produce sin preaviso y es causa de mortalidad en deportistas jóvenes de élite. Foto: DM.
La muerte súbita se produce sin preaviso y es causa de mortalidad en deportistas jóvenes de élite. Foto: DM.
 Equipo del CNIC que ha llevado a cabo la investigación. Foto: CNIC.
Equipo del CNIC que ha llevado a cabo la investigación. Foto: CNIC.
 El desarrollo de modelo cutÃĄneos en 3D abre la puerta al estudio de enfermedades sensoriales con clÃnica cutÃĄnea. Foto: UMH.
El desarrollo de modelo cutÃĄneos en 3D abre la puerta al estudio de enfermedades sensoriales con clÃnica cutÃĄnea. Foto: UMH.
 Asia FernÃĄndez, catedrÃĄtica del Ãrea de BiologÃa Molecular y Celular de la UMH. Foto: UMH.
Asia FernÃĄndez, catedrÃĄtica del Ãrea de BiologÃa Molecular y Celular de la UMH. Foto: UMH.
 Las tÃĐcnicas de imagen establecen diagnÃģsticos diferenciales en patologÃa de la mama. Foto: DM.
Las tÃĐcnicas de imagen establecen diagnÃģsticos diferenciales en patologÃa de la mama. Foto: DM.
 Alejandro Tejerina, Luis Ortiz Quintana, Javier Arias, Armando Tejerina, Miguel MartÃn, Ãlvaro Ruibal y Raquel Serrano, en la presentaciÃģn de 'Imagen MÃĐdica en PatologÃa Mamaria', en la UCM. Foto: FUNDACIÃN TEJERINA.
Alejandro Tejerina, Luis Ortiz Quintana, Javier Arias, Armando Tejerina, Miguel MartÃn, Ãlvaro Ruibal y Raquel Serrano, en la presentaciÃģn de 'Imagen MÃĐdica en PatologÃa Mamaria', en la UCM. Foto: FUNDACIÃN TEJERINA.
 El dolor en miembros perifÃĐricos es caracterÃstico de la neuropatÃa diabÃĐtica. Foto. SUTTERSTOCK.
El dolor en miembros perifÃĐricos es caracterÃstico de la neuropatÃa diabÃĐtica. Foto. SUTTERSTOCK.
 MarÃa Madariaga, Mercedes Maderuelo, MarÃa PÃĐrez PÃĄramo y JosÃĐ Ãngel DÃaz PÃĐrez, en la presentaciÃģn de la encuesta internacional sobre neuropatÃa diabÃĐtica. Foto: FEDE.
MarÃa Madariaga, Mercedes Maderuelo, MarÃa PÃĐrez PÃĄramo y JosÃĐ Ãngel DÃaz PÃĐrez, en la presentaciÃģn de la encuesta internacional sobre neuropatÃa diabÃĐtica. Foto: FEDE.
 El tejido adiposo marrÃģn, aliado en el abordaje de la obesidad. Foto: AGEFOTOSTOCK.
El tejido adiposo marrÃģn, aliado en el abordaje de la obesidad. Foto: AGEFOTOSTOCK.
 La formaciÃģn de tejido cicatricial dentro del Útero es la principal caracterÃstica del Asherman. Foto. DM.
La formaciÃģn de tejido cicatricial dentro del Útero es la principal caracterÃstica del Asherman. Foto. DM.
 Carlos SimÃģn, en el centro de la imagen, junto a su equipo de investigaciÃģn. Foto. INCLIVA.
Carlos SimÃģn, en el centro de la imagen, junto a su equipo de investigaciÃģn. Foto. INCLIVA.
 Drew Weissman y Katalin KarikÃģ han recibido del premio Nobel de Medicina 2023. Foto: DM.
Drew Weissman y Katalin KarikÃģ han recibido del premio Nobel de Medicina 2023. Foto: DM.
 La temperatura oral estÃĄ sujeta a variables que han de tenerse en cuenta. Foto: SUTTERSTOCK.
La temperatura oral estÃĄ sujeta a variables que han de tenerse en cuenta. Foto: SUTTERSTOCK.
 Las enfermedades cardiovascular siguen siendo la primera causa de muerte en el mundo. Foto: SUTTERSTOCK.
Las enfermedades cardiovascular siguen siendo la primera causa de muerte en el mundo. Foto: SUTTERSTOCK.
 Maite San Saturnino, JuliÃĄn PÃĐrez VillacastÃn, FÃĄtima Matute y Luis RodrÃguez Padial. Foto: SEC.
Maite San Saturnino, JuliÃĄn PÃĐrez VillacastÃn, FÃĄtima Matute y Luis RodrÃguez Padial. Foto: SEC.
 Numerosos laboratorios de todo el mundo investigan el origen y los efectos de la covid persistente. Foto: AGEFOTOSTOCK.
Numerosos laboratorios de todo el mundo investigan el origen y los efectos de la covid persistente. Foto: AGEFOTOSTOCK.
 Los sÃntomas de la covid persistente son variados y pueden ser de leves a graves. Foto: AGEFOTOSTOCK.
Los sÃntomas de la covid persistente son variados y pueden ser de leves a graves. Foto: AGEFOTOSTOCK.
 Los linfocitos T parecen estar mÃĄs activados, y durante mÃĄs tiempo, en afectados por esta enfermedad. Foto: AGEFOTOSTOCK.
Los linfocitos T parecen estar mÃĄs activados, y durante mÃĄs tiempo, en afectados por esta enfermedad. Foto: AGEFOTOSTOCK.
 Ciertos tipos de quimioterapia pueden inducir cardiotoxicidades importantes. Foto: DM.
Ciertos tipos de quimioterapia pueden inducir cardiotoxicidades importantes. Foto: DM.
 Pilar SepÚlveda, responsable del Grupo de InvestigaciÃģn en RegeneraciÃģn y Trasplante Cardiaco del IIS La Fe de Valencia. Foto: ISS La Fe.
Pilar SepÚlveda, responsable del Grupo de InvestigaciÃģn en RegeneraciÃģn y Trasplante Cardiaco del IIS La Fe de Valencia. Foto: ISS La Fe.
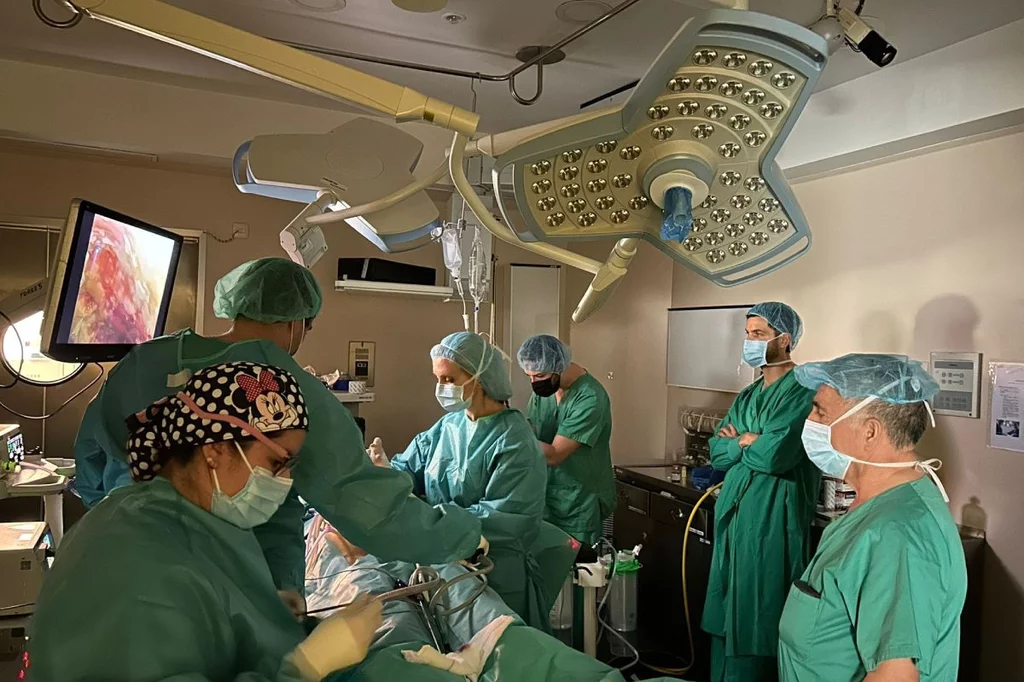 El equipo de Delia CortÃĐs, a la derecha de la imagen, realizando una cirugÃa con ePIPAC, pionera en EspaÃąa. Foto: HOSPITAL VIAMED SANTA ELENA MADRID.
El equipo de Delia CortÃĐs, a la derecha de la imagen, realizando una cirugÃa con ePIPAC, pionera en EspaÃąa. Foto: HOSPITAL VIAMED SANTA ELENA MADRID.
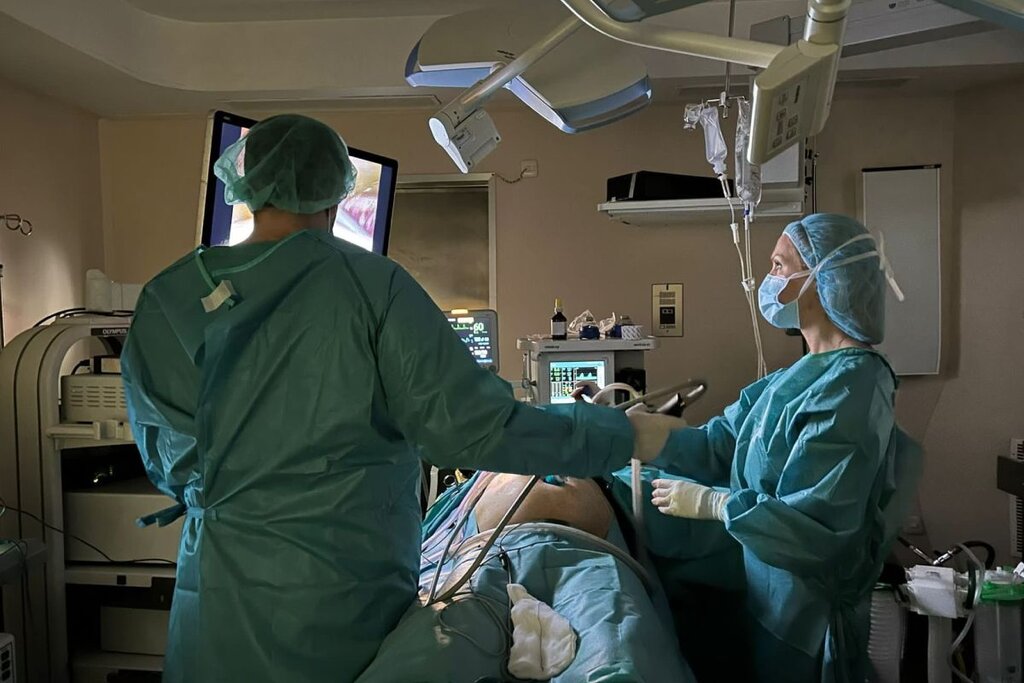 La ePIPAC se lleva a cabo mediante cirugÃa laparoscÃģpica. Foto: HOSPITAL VIAMED SANTA ELENA.
La ePIPAC se lleva a cabo mediante cirugÃa laparoscÃģpica. Foto: HOSPITAL VIAMED SANTA ELENA.
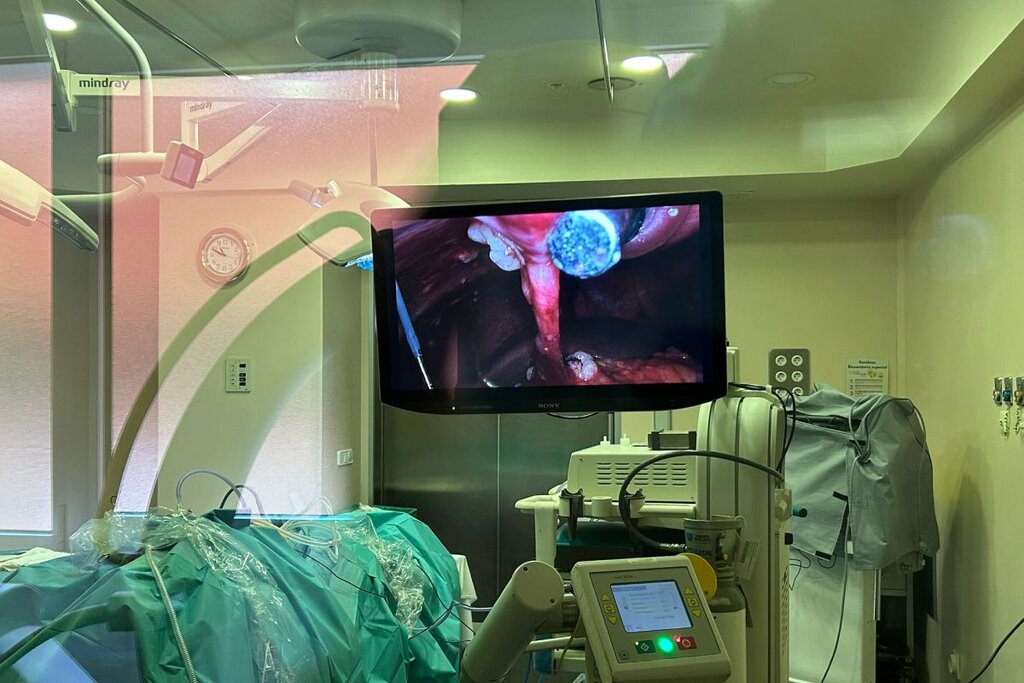 La ePIPAC aporta mayores beneficios al abordaje de la carcinomatosis peritoneal. Foto. HOSPITAL VIAMED SANTA ELENA.
La ePIPAC aporta mayores beneficios al abordaje de la carcinomatosis peritoneal. Foto. HOSPITAL VIAMED SANTA ELENA.
 El colesterol puede acumularse en sangre y ser causa de eventos cardiovasculares. Foto: DM.
El colesterol puede acumularse en sangre y ser causa de eventos cardiovasculares. Foto: DM.
 Pedro Mata, presidente de la FundaciÃģn Hipercolesterolemia Familiar (FHF). Foto: DM.
Pedro Mata, presidente de la FundaciÃģn Hipercolesterolemia Familiar (FHF). Foto: DM.
 Javier De Castro, Enriqueta Felip y CÃĐsar RodrÃguez, responsables de SEOM. Foto: SEOM.
Javier De Castro, Enriqueta Felip y CÃĐsar RodrÃguez, responsables de SEOM. Foto: SEOM.
 La patologÃa endometrial puede conducir a problemas de infertilidad. Foto: SUTTERSTOCK.
La patologÃa endometrial puede conducir a problemas de infertilidad. Foto: SUTTERSTOCK.
 MÃģnica Romeu, Irene CervellÃģ, MarÃa GÃģmez, Amparo Faus, Adolfo RodrÃguez, Ana MonzÃģ, del grupo de investigaciÃģn que ha participado en el trabajo. Foto: IIS LA FE.
MÃģnica Romeu, Irene CervellÃģ, MarÃa GÃģmez, Amparo Faus, Adolfo RodrÃguez, Ana MonzÃģ, del grupo de investigaciÃģn que ha participado en el trabajo. Foto: IIS LA FE.
 En el estudio se han evaluado distintos derivados del triptÃģfano para caracterizar nuevos antivirales. Foto: iStock/CSIC.
En el estudio se han evaluado distintos derivados del triptÃģfano para caracterizar nuevos antivirales. Foto: iStock/CSIC.
 Javier Urra y Celso Arango en el Hospital de DÃa Retiro Recurra GINSO, en Madrid. Foto: JOSÃ LUIS PINDADO.
Javier Urra y Celso Arango en el Hospital de DÃa Retiro Recurra GINSO, en Madrid. Foto: JOSÃ LUIS PINDADO.
 Celso Arango insiste en la importancia de la atenciÃģn multimodal y multidisciplinar. Foto: JOSÃ LUIS PINDADO.
Celso Arango insiste en la importancia de la atenciÃģn multimodal y multidisciplinar. Foto: JOSÃ LUIS PINDADO.
 Javier Urra considera que estos centros controlan la patologÃa, pero tambiÃĐn enseÃąar a afrontar la vida. Foto: JOSÃ LUIS PINDADO.
Javier Urra considera que estos centros controlan la patologÃa, pero tambiÃĐn enseÃąar a afrontar la vida. Foto: JOSÃ LUIS PINDADO.
 La bacteria que ocasiona el botulismo es una de las mÃĄs peligrosas de las que se conocen. Foto: SHUTTERSTOCK.
La bacteria que ocasiona el botulismo es una de las mÃĄs peligrosas de las que se conocen. Foto: SHUTTERSTOCK.
 Araceli Arce, subdirectora de Vigilancia en Salud PÚblica de la Comunidad de Madrid. Foto: CAM.
Araceli Arce, subdirectora de Vigilancia en Salud PÚblica de la Comunidad de Madrid. Foto: CAM.
 La obesidad en niÃąos y adolescentes sigue siendo un problema de salud preocupante en el mundo. Foto: SUTTERSTOCK.
La obesidad en niÃąos y adolescentes sigue siendo un problema de salud preocupante en el mundo. Foto: SUTTERSTOCK.
 JosÃĐ Manuel Moreno Villares, director de PediatrÃa de la ClÃnica Universidad de Navarra. Foto. CUN.
JosÃĐ Manuel Moreno Villares, director de PediatrÃa de la ClÃnica Universidad de Navarra. Foto. CUN.
 El sistema inmunitario es una de las partes mÃĄs complejas de nuestro organismo. Foto: SUTTERSTOCK.
El sistema inmunitario es una de las partes mÃĄs complejas de nuestro organismo. Foto: SUTTERSTOCK.
 GrÃĐgoire Stik, , jefe de Grupo del Instituto de InvestigaciÃģn contra la Leucemia Josep Carreras. Foto: INSTITUTO CARRERAS.
GrÃĐgoire Stik, , jefe de Grupo del Instituto de InvestigaciÃģn contra la Leucemia Josep Carreras. Foto: INSTITUTO CARRERAS.
 Los cientÃficos buscan respuestas para algunas de las casuas de la covid persistente. Foto: DM.
Los cientÃficos buscan respuestas para algunas de las casuas de la covid persistente. Foto: DM.
 Las mascotas no suponen un peligro de transmisiÃģn del SARS-CoV-2 para los humanos, pero sà a la inversa. Foto: DM.
Las mascotas no suponen un peligro de transmisiÃģn del SARS-CoV-2 para los humanos, pero sà a la inversa. Foto: DM.
 LucÃa de Juan FerrÃĐ, del Grupo de InvestigaciÃģn Vigilancia Sanitaria, del Centro Visavet de la Universidad Complutense de Madrid (UCM). Foto: UCM.
LucÃa de Juan FerrÃĐ, del Grupo de InvestigaciÃģn Vigilancia Sanitaria, del Centro Visavet de la Universidad Complutense de Madrid (UCM). Foto: UCM.